أثار الرئيس الأمريكي دونالد ترامب جدلاً واسعاً بتصريحاته الأخيرة التي ربطت بين استخدام «البانادول» (أي الأسيتامينوفين/باراسيتامول) أثناء الحمل وزيادة احتمال حدوث التوحد، داعياً النساء الحوامل إلى تجنبه إلا في حالات الضرورة القصوى.
كما دعا إلى اعتماد دواء الليوكوفورين (leucovorin) كعلاج محتمل لجزء من أعراض التوحد، مستنداً إلى فكرة أن نقص الفولات داخل الدماغ قد يساهم بظهور خصائص طيف التوحد، وأن الليوكوفورين قد يعوض ذلك الخلل.
التصريح أصبح حديث الناس الأيام القليلة الماضية. هذا المقال سيحاول الرد على هذا التصريح بطريقة غير مباشرة، فالرد المباشر هو دور المؤسسات الرسمية الصحية في مختلف أنحاء العالم، وقد قامت هذه المؤسسات بدورها، فقد توالت الردود من هيئة الغذاء الدواء الأمريكية ومنظمة الصحة العالمية والعديد من الهيئات الطبية المتخصصة في امريكا مثل منظمة الطب النفسي واطباء النساء والولادة ومنظمة مرض التوحد والكثير غيرهم.

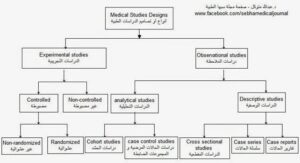
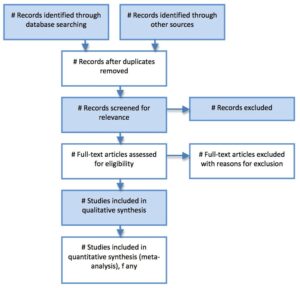
سأحاول في هذا المقال التوعوي المقدم للجمهور المهتم بالعلم، تقديم شرحاً مختصراً لأبرز أنواع الدراسات في المجال الصحي، مع التركيز على ميزاتها، محدودياتها، استعمالاتها، العوامل المؤثرة في دقتها، ومستويات قوتها وضعفها، بالإضافة إلى أمثلة متعددة لكل نوع. سيساعد ذلك في فهم كيفية إجراءات الدراسات العلمية الصحية، لأني معتقد بأهمية تعريف القارئ بهذا الجانب العلمي والبحثي من الممارسة الصحية، وخصوصاً الممارسين الصحيين بحكم التصاقهم بهذا المجال.
وفي الختام، سأحاول عرض الخلاصة العلمية التي جمعتها عن وبيان الدراسات التي اعتمدها فريق الرئيس في تصريحه، وملخص لآراء الخبراء وتقييمهم النقدي لها.
مقدمة عن الدراسات العلمية
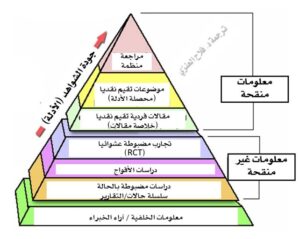
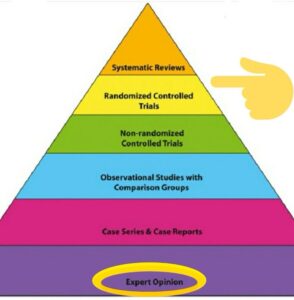
تشكل الدراسات العلمية الركيزة الأساسية لتطوير المعرفة العلمية وتحسين الرعاية الصحية. تهدف هذه الدراسات إلى فهم الأمراض، تقييم التدخلات الطبية، وتحديد العوامل المؤثرة في الصحة العامة. تصنف الدراسات العلمية في المجال الصحي بناءً على تصميمها، سواء كانت وصفية أو تحليلية أو تجريبية، وتختلف مستويات قوتها العلمية حسب هرم الأدلة العلمية (Evidence Pyramid)، حيث تكون المراجعات المنهجية والتحليلات التراكمية (Systematic Reviews & Meta-Analyses) في القمة كأقوى الأدلة، تليها التجارب العشوائية المضبوطة، ثم الدراسات التحليلية المراقبة، وأخيراً الدراسات الوصفية في القاعدة كأضعفها.
يعتمد مستوى القوة على قدرة الدراسة على إثبات العلاقة السببية، تقليل التحيزات، وتعميم النتائج. أما الضعف فيأتي من عوامل مثل عدم القدرة على التحكم في المتغيرات أو صغر حجم العينة.
باختصار: إذا ثبتت المعلومة بالدليل العلمي القوي، الرأي الشخصي غير مهم.
الدراسات الوصفية (Descriptive Studies)
تُعد الدراسات الوصفية أبسط أنواع الدراسات العلمية في المجال الصحي، حيث تركز على وصف الظواهر الصحية دون محاولة تفسير العلاقات السببية. تشمل أنواعاً فرعية مثل تقارير الحالات (Case Reports)، سلسلة الحالات (Case Series)، والاستطلاعات الوبائية (Ecological Studies) أو الدراسات المقطعية الوصفية (Cross-sectional studies).
الميزات
من أبرز ميزاتها بساطتها وتكلفتها المنخفضة، ما يجعلها مثالية للبحوث الأولية. تسمح بتوليد فرضيات جديدة من خلال رصد الأنماط، وتكون سريعة التنفيذ مقارنة بالدراسات التحليلية. كما أنها لا تتطلب تدخلاً، مما يقلل من المخاطر الأخلاقية.
المحدوديات
تكمن محدودياتها في عدم القدرة على إثبات السببية، حيث أن بعض الارتباطات في الدراسات الوصفية قد تكون مصادفة. تعاني من تحيزات مثل تحيز الاختيار (Selection Bias) إذا لم تكن العينة تمثيلية، ولاتسمح بتعميم النتائج على مجموعات أكبر. كذلك، قد تكون غير دقيقة بسبب الاعتماد على البيانات الذاتية.
الاستعمالات
تُستخدم لوصف انتشار الأمراض، مثلا في الوبائيات،أو لتوثيق حالات نادرة. تعتبر الدراسات الوصفية مثالية للكشف عن مشكلات صحية جديدة أو مراقبة الاتجاهات الصحية في المجتمعات.
العوامل المؤثرة في الدقة
تشمل حجم العينة، جودة جمع البيانات، وطريقة التوثيق. الدقة فيها تتأثر سلباً بالتحيزات الذاتية للباحثين أو عدم دقة السجلات الطبية. كما أن استخدام أدوات قياس موثوقة يعزز الدقة.
مستوى القوة والضعف
في هرم الأدلة، تُصنف كأضعف مستوى (المستوى 5)، لأنها لا توفر دليلاً قوياً على السببية، لكنها قوية في توليد أفكار بحثية جديدة. ضعفها الرئيسي يكمن في عدم القدرة على التحكم في المتغيرات.
الأمثلة
أولاً، تقرير حالة عن مريض مصاب بفيروس كورونا المستجد (COVID-19) مع أعراض نادرة مثل فقدان الشم، نشر في مجلة “The New England Journal of Medicine” عام 2020، ساعد في وصف الأعراض الأولية. ثانياً، سلسلة حالات عن مرضى مصابين بسرطان الرئة الناتج عن التدخين، كما في دراسة نشرت في “British Medical Journal” عام1950، والتي أدت إلى فرضيات عن الارتباط بين التدخين والسرطان. ثالثاً، استطلاع وبائي وصفي عن انتشار السمنة في الولايات المتحدة، كما في تقريرCDC عام 2019، الذي وصف نسب الانتشار دون تحليل الأسباب.
الدراسات المقطعية (cross-sectional Studies)
الدراسات المقطعية هي دراسات تحليلية مراقبة تقيس التعرض والنتيجة في وقت واحد، مما يجعلها مفيدة لقياس الانتشار (Prevalence).
الميزات
ميزتها الرئيسية السرعة والتكلفة المنخفضة، حيث تُجرى في لحظة زمنية واحدة. تسمح بتقييم عوامل متعددة في وقت واحد وتوليد فرضيات.
المحدوديات
لا تستطيع إثبات السببية بسبب عدم القدرة على تحديد الترتيب الزمني (Temporal Sequence). تعاني من تحيز البقاء (Survivor Bias) وتحيز الاستذكار(Recall Bias) إذا اعتمدت على استطلاعات.
الاستعمالات
تُستخدم لقياس انتشار الأمراض أو السلوكيات الصحية، مثل استطلاعات الصحة العامة أو تقييم عوامل الخطر.
العوامل المؤثرة في الدقة
حجم العينة الكبير يعزز الدقة، لكن التحيز في اختيار العينة يقللها. جودة الاستبيانات والتحليل الإحصائي بها مهم.
مستوى القوة والضعف
مستوى متوسط ضعيف (المستوى 4 في الهرم)، قوية في وصف الانتشار لكنها ضعيفة في إثبات السببية مقارنة بالدراسات الطولية.
الأمثلة
أولاً، دراسة مقطعية عن انتشار الاكتئاب بين الطلاب الجامعيين في السعودية، نشرت في “Journal of Affective Disorders” عام 2021، قاست الانتشار والعوامل المرتبطة. ثانياً، استطلاع NHANES الأمريكي عام 2022 عن انتشار ارتفاع ضغط الدم، الذي وصف الانتشار حسب العمر والجنس. ثالثاً، دراسة عن استخدام الهواتف الذكية ومشاكل النوم بين المراهقين في أوروبا، نشرت في “Sleep Medicine” عام 2018.
دراسات الحالات والشواهد (Case-Control Studies)
هذه الدراسات التحليلية المراقبة تقارن مجموعة مصابة(الحالات) بمجموعة غير مصابة (الشواهد) لتحديد عوامل الخطر.
الميزات
تتميز بالفعالية في دراسة الأمراض النادرة، والتكلفة المنخفضة نسبياً، مع القدرة على تقييم عوامل الخطر المتعددة.
المحدوديات
تعاني من تحيز الاستذكار وتحيز الاختيار، ولا تحسب الانتشار أو الحدوث. صعبة في مطابقة الشواهد بدقة.
الاستعمالات
مثالية لتحديد عوامل الخطر في الأمراض النادرة أو الوبائيات، مثل دراسات السرطان أو الأمراض المعدية.
العوامل المؤثرة في الدقة
مطابقة الشواهد جيداً (Matching) تعزز الدقة، لكن سوء الاستذكار يقللها. التحليل الإحصائي مثل نسبة الاحتمال (Odds Ratio) مهم.
مستوى القوة والضعف
مستوى متوسط (المستوى 3b)، قوية في توليد فرضيات عن عوامل الخطر لكنها ضعيفة في إثبات السببية بسبب الطبيعة الرجعية.
الأمثلة
أولاً، دراسة عن الارتباط بين التدخين وسرطان الرئة، كمافي بحث دول وهيل عام 1950. ثانياً، دراسة عن فيروس الورم الحليمي البشري (HPV) والسرطان الرحمي،نشرت في “The Lancet” عام 1999. ثالثاً، دراسة عن استخدام الهواتف المحمولة والأورام الدماغية، كما في مشروع (INTERPHONE) عام 2010.
دراسات الأتراب أو الحشدية (Cohort Studies)
الدراسات الحشدية تتابع مجموعة من الأشخاص مع مرور الزمن لقياس الحدوث (Incidence) والعوامل المؤثرة.
الميزات
ميزتها القدرة على إثبات الترتيب الزمني، مما يقربها من السببية. تسمح بحساب الحدوث والمخاطر النسبية (Relative Risk).
المحدوديات
طويلة الأمد ومكلفة، وتعاني من مشكلة فقدان المتابعة (Loss to Follow-up) ، وهي غير مناسبة للأمراض النادرة.
الاستعمالات
تُستخدم لدراسة تطور الأمراض أو تأثير التدخلات الوقائية، مثل دراسات الصحة العامة الطولية.
العوامل المؤثرة في الدقة
معدل المتابعة العالي يعزز الدقة، لكن التحيز في المتابعة يقللها. حجم العينة الكبير ضروري.
مستوى القوة والضعف
مستوى متوسط قوي (المستوى 2b)، قوية في إثبات السببية مقارنة بالحالات والشواهد، لكن تكلفتها عالية.
الأمثلة
أولاً، دراسة فرامنغهام لأمراض القلب (Framingham Heart Study) منذ 1948، تتابع عوامل الخطر لأمراض القلب. ثانياً، دراسة ممرضات هارفارد (Nurses’ Health Study) عن التغذية والسرطان. ثالثاً، دراسة أتراب عن التطعيم ضد كوفيد-19 وفعاليته،نشرت في “NEJM” عام 2021.
التجارب العشوائية المضبوطة (Randomized Controlled Trials – RCTs)
التجارب العشوائية هي دراسات تجريبية حيث يُخصص المشاركين عشوائياً إلى مجموعات تدخّل ومقارنة.
الميزات
أقوى في إثبات السببية بفضل العشوائية التي تقلل التحيزات. تسمح بتقييم فعالية التدخلات بدقة.
المحدوديات
مكلفة وطويلة، وقد تصطدم بقضايا أخلاقية إذا كان التدخل ضاراً. قد لا تعكس الواقع الخارجي (External Validity).
الاستعمالات
تُستخدم لتقييم الأدوية أو العلاجات، مثل التجارب السريرية للأدوية الجديدة.
العوامل المؤثرة في الدقة
العشوائية والعمى (Blinding) يعززان الدقة، لكن عدم الامتثال يقللها. التحليل بنية العلاج (Intention-to-Treat) مهم.
مستوى القوة والضعف
أعلى مستوى (المستوى 1b)، قوية في السببية لكنها أضعف في التطبيق على مجموعات واسعة.
الأمثلة
أولاً، تجربة فايزر للقاح كوفيد-19 عام 2020. ثانياً،تجربة (ASPREE) عن الأسبرين في الوقاية من الأمراض عند كبار السن. ثالثاً، تجربة (ALLHAT) عن علاج ارتفاع ضغط الدم.
المراجعات المنهجية والتحليلات الوصفية (Systematic Reviews and Meta-Analyses)
هذه دراسات ثانوية تجمع وتحلل نتائج دراسات سابقة بشكل منهجي.
الميزات
توفر أدلة مجمعة قوية، تزيد من حجم العينة الفعال، وتقلل التحيزات من خلال المنهجية الصارمة.
المحدوديات
تعتمد على جودة الدراسات الأساسية (Garbage In, Garbage Out). قد يكون هناك تحيز نشر (Publication Bias).
الاستعمالات
تُستخدم لصياغة الإرشادات الطبية، مثل تلك من (Cochrane Collaboration).
العوامل المؤثرة في الدقة
شمولية البحث وتقييم الجودة (مثل PRISMA) يعززان الدقة. التحليل الإحصائي للتباين مهم.
مستوى القوة والضعف
أعلى مستوى (المستوى 1a)، قوية في التعميم لكنها ضعيفة إذا كانت الدراسات الأولية ضعيفة.
الأمثلة
أولاً، مراجعة كوكرين المنهجية عن فعالية المضادات الحيوية في التهابات الجهاز التنفسي.
ثانياً، دراسات ميتا الشاملة عن التمارين والاكتئاب في“JAMA” عام 2018. ثالثاً، مراجعة عن لقاحات كوفيد-19 وآثارها الجانبية.
العوامل المؤثرة سلباً على الدراسات العلمية وأنواع التحيزات في المجال الصحي
في مجال الدراسات العلمية الصحية، تعتبر الدقة والموثوقية أمراً أساسياً لاتخاذ قرارات طبية مستنيرة وتطوير علاجات فعالة. ومع ذلك، تواجه هذه الدراسات تحديات عديدة تؤثر سلباً في نتائجها، مما قد يؤدي إلى استنتاجات خاطئة أو غير دقيقة. تشمل هذه العوامل السلبية جوانب متعددة مثل التصميم الدراسي السيء،أخطاء في جمع البيانات، والتحيزات المختلفة.
سنستعرض العوامل السلبية الرئيسية المؤثرة على دقة الدراسات الصحية، مع التركيز على أنواع التحيزات الشائعة، مدعماً بأمثلة وطرق للتخفيف منها، لفهم أفضل لكيفية تحسين جودة البحث الطبي.
العوامل التالية هي بعض العوامل التي قد تؤدي إلى انحراف النتائج عن الحقيقة:
أولاً، العيوب في التصميم الدراسي، مثل عدم العشوائية في التجارب أو عدم التحكم في المتغيرات، تؤدي إلى انحرافات معيارية.
ثانيا، أخطاء جمع البيانات في البحث العلمي متنوعة وتشمل الجوانب المنهجية والتقنية والبشرية، ويمكن أن تؤدي إلى انحراف النتائج وتقليل موثوقية البحث.
ثالثا، حجم العينة غير الكافي (Inappropriate Sample Size) يُعد من أبرز العوامل السلبية. عندما تكون العينة صغيرة، تزداد احتمالية الخطأ العشوائي،مما يقلل من القوة الإحصائية وقدرة الدراسة على كشف الآثار الحقيقية. على سبيل المثال، في دراسات تشخيصية، قد يؤدي ذلك إلى تقديرات غير دقيقة للحساسية والنوعية.
رابعا، المتغيرات المشوشة (Confounding Variables) تسبب ارتباكاً في العلاقات السببية، حيث يُنسب تأثير متغير آخر إلى المتغير الرئيسي. مثل ما في دراسات التدخين والأمراض القلبية، حيث قد يُخلط بين التدخين والعوامل الاجتماعية الاقتصادية.
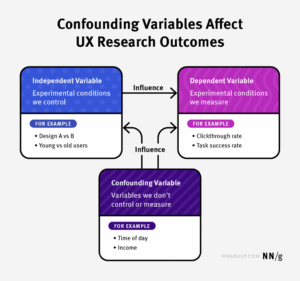
خامساً، أخطاء في تطبيق الاختبارات الإحصائية (Errors in Statistical Tests) تشمل الخطأ منالنوع الأول (Type I Error)، حيث يتم رفض فرضية صفرية صحيحة، أو النوع الثاني (Type II Error)،حيث يتم قبول فرضية خاطئة. هذه الأخطاء تنشأ من سوء اختيار الاختبارات أو عدم تصحيح النتيجة عبر استخدام اختبارات متعددة.
سادساً، مصادر التمويل قد تؤثر سلباً، حيث يميل الباحثون الممولون من شركات الأدوية إلى نتائج إيجابية كثر.
سابعاً، التحيزات الإدراكية للباحثين، مثل الثقة الزائدة (Overconfidence) أو تأثير الترسيخ (Anchoring Effect)، تؤثر على تفسير البيانات، مما يقلل من الموضوعية. التحيز (Bias) هو أي خطأ منهجي يؤدي إلى تقدير غير دقيق للعلاقة بين عنصر الاختبار (المتغير) والنتيجة، كما يُعرف في الوبائيات. يمكن أن ينشأ التحيز في مراحل مختلفة في الدراسة، مثل الاختيار، القياس، أو التفسير.

أنواع التحيزات الشائعة
تنقسم التحيزات في الدراسات الصحية إلى فئات رئيسية، وفقاً لكتالوج التحيزات (Catalog of Bias):
أولاً، تحيز الاختيار (Selection Bias): يحدث عندما لاتكون العينة تمثيلية للمجتمع المستهدف، مما يؤدي إلى نتائج منحازة. على سبيل المثال، في دراسات المستشفيات، قد يُختار المرضى الشديدي الإصابة فقط، مما يبالغ في تقدير شدة المرض (Admission Rate Bias).
ثانياً، تحيز القياس (Measurement Bias): ينشأ من أخطاء في قياس المتغيرات، مثل تحيز الاستذكار (Recall Bias) حيث يتذكر المرضى التجارب السلبية أكثر من الآخرين، كما في دراسات التعرض للمواد الكيميائية. كذلك، تحيز الإبلاغ الذاتي (Self-Reporting Bias) يحدث عندما يخفي المشاركون معلومات حساسة، مثل استطلاعات الإدمان.
ثالثاً، تحيز التدخل أو التعرض (Intervention Bias): يظهر في التجارب عندما يعرف المشاركون مجموعتهم، مما يؤثر على سلوكهم (Performance Bias).
رابعاً، تحيز التأكيد (Confirmation Bias): يبحث الباحثون عن أدلة تدعم آرائهم مسبقاً، متجاهلين الأدلة المعاكسة، كما في تفسير نتائج الدراسات التشخيصية.
خامساً، تحيز النشر (Publication Bias): تنشر الدراسات ذات النتائج الإيجابية أكثر، مما يشوه الصورة العامة، كما في مراجعات الأدوية.
سادساً، التحيزات الضمنية (Implicit Bias): تشمل التحيزات العنصرية أو الجنسية في الرعاية الصحية، حيث يتلقى الأقليات علاجاً أقل جودة. سابعاً، تحيز التحقق الجزئي (Partial Verification Bias): في الدراسات التشخيصية، يُختبر بعض المرضى فقط، مما يبالغ في الحساسية.
كيفية التخفيف من هذه العوامل والتحيزات
لتقليل التأثير السلبي، يجب اتباع معايير مثل (STARD) للدراسات التشخيصية، التي تؤكد على التصميم السليم والإبلاغ الشفاف. استخدام العشوائية، الإعماء (Blinding)، والمطابقة (Matching) يقلل من التحيزات. كما يساعد التحليل الإحصائي المتعدد المتغيرات في السيطرة على المشوشات. في الدراسات الكبيرة، يُفضل تسجيل الدراسات مسبقاً لتجنب تحيز النشر.
رجوعاً للبيان الصادر عن البيت الأبيض بعنوان “FACT: Evidence Suggests Link Between Acetaminophen, Autism” (22 سبتمبر 2025)، ورد:
• أن هناك دراسات واسعة النطاق للأتراب (cohort studies) مثل (Nurses’ Health Study II و Boston Birth Cohort) التي تُظهر ارتباطًا بين تعرّض الجنين لأسيتامينوفين (acetaminophen) أثناء الحمل وبين تشخيصات التوحد (ASD) وفرط الحركة وتشتت الانتباه (ADHD).
• أن هناك مراجعة علمية ضمن جامعة هارفارد (Harvard) مدعومة بمنحة من المعاهد الوطنية للصحة (NIH) بحثت عن المخاطر المحتملة عند استخدام الأسيتامينوفين أثناء الحمل ووجدت “دليلًا على وجود ارتباط” مع اضطرابات النمو العصبي لدى الأطفال.
• أن دراسات من مؤسسات مثل (Johns Hopkins و Mount Sinai) أيضًا تبرز وجود ارتباط مماثل.
• كما ورد أن هناك بيانًا دوليًا (international consensus statement) عام 2021 دعا إلى “تصرّف احترازي” (precautionary action)، أي استعمال أقل جرعة فعالة وفي أقصر وقت ممكن من الأسيتامينوفين أثناء الحمل.
ملاحظات نقدية مهمة على هذه الدراسات
• غالبية الدراسات هي دراسات ملاحظة (observational / cohort)، وليست تجارب عشوائية (randomized trials)، لذا لا يمكنها أن تثبت السببية بحسم.
• في بعض الدراسات، التعرض يعتمد على تقارير الأم (Recall) بعد الحمل، ما قد يُدخل تحيّز الذاكرة (recall bias).
• استخدام تصميم مقارنة الأشقاء في بعض الدراسات أظهر أن بعض الارتباطات قد تُفسَّر بعوامل وراثية أو بيئية مشتركة، وليس بجرعة الأسيتامينوفين ذاتها.
• هناك تباين كبير في جودة الدراسات (من حيث تقدير الجرعة، التوقيت، المتغيرات المربكة (confounders) التي يُحتمل أن تؤثر، جودة المتابعات، حجم العيّنات).
• الدراسات التي استُشهد بها في البيان غالبًا ما تُعرض بعناوين “ارتباط” وليس إثبات أن الأسيتامينوفين “يسبب” التوحد. في الواقع، حتى مراجعة (Navigation Guide) تقول إنها تدعم وجود ارتباط ولكن لا تثبت السببية.
• بعض الجهات الأكاديمية والطبية – مثل الكلية الأمريكية لأطباء التوليد وأمراض النساء (ACOG) – رفضت أن يُصدر تصريح عام بأن الأسيتامينوفين يسبب التوحد، معتبرة أن الأدلة غير كافية لهذا المستوى من التأكيد.
الخاتمة
في الختام، تتنوع الدراسات العلمية في المجال الصحي لتلبية احتياجات البحث المختلفة، مع التركيز على تحقيق الدقة من خلال تقليل التحيزات واختيار التصميم المناسب. يساعد فهم مستويات القوة والضعف في اتخاذ قرارات طبية مستنيرة، مما يعزز الرعاية الصحية. يجب على الباحثين الالتزام بالمعايير الأخلاقية والمنهجية لضمان دقة النتائج.

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية

مقال اكثر من رائع دكتور غسان ..
most of references classified cross-sectional study as analytical studies not a descriptive study