يشهد مجال أبحاث طول العمر (Longevity) تطورًا كبيرًا في العقود الأخيرة، حيث تركّز الجهود العلمية على فهم آليات الشيخوخة وإبطائها أو عكسها باستخدام أدوية وتقنيات متقدمة.
تُعرف هذه الأدوية أحيانًا بـ “geroprotectors” أو “أدوية مكافحة الشيخوخة”، وهي تهدف إلى معالجة الشيخوخة كعملية بيولوجية وليس مجرد علاج للأمراض.

لم يأت مفهوم أدوية إطالة العمر من فراغ. بل هو نتاج قرون من الملاحظة والبحث عن طرق لمكافحة التدهور المرتبط بالشيخوخة. تاريخياً، ركزت الجهود على العلاجات التقليدية والنباتات الطبية التي يُعتقد أن لها خصائص مجددة.
البدايات المبكرة: في القرن العشرين، ومع تطور علم الأحياء الجزيئي والخلوي، بدأ العلماء في فهم أن الشيخوخة ليست مجرد عملية سلبية من التدهور، بل هي عملية بيولوجية معقدة تنطوي على مسارات جزيئية وخلوية قابلة للتأثير.
التحول الكبير: شهدت العقود الأخيرة تحولاً جذرياً في هذا المجال، حيث لم يعد التركيز على علاج الأمراض المرتبطة بالشيخوخة بشكل فردي (مثل السكري، أمراض القلب، السرطان)، بل على استهداف عمليات الشيخوخة الأساسية نفسها.
الفرضية هي أنه إذا تمكنا من إبطاء أو عكس هذه العمليات، فإننا بذلك نؤخر ظهور مجموعة واسعة من الأمراض المرتبطة بالعمر ونحسن من “مدة الصحة” (Healthspan) وليس فقط “مدة الحياة” (Lifespan).
المفاهيم الأساسية لشيخوخة الخلوية والجزيئية
لفهم أدوية إطالة العمر، من الضروري استيعاب الأسباب الجذرية للشيخوخة على المستوى الخلوي والجزيئي.
حدد العلماء “سمات الشيخوخة” (Hallmarks of Aging) الرئيسية التي تعتبر الدوافع الأساسية لهذه العملية. تشمل هذه السمات:
عدم استقرار الجينوم (Genomic Instability): تراكم الأضرار في الحمض النووي (DNA).
تآكل التيلوميرات (Telomere Attrition): قِصر نهايات الكروموسومات.
التغيرات اللاجينية (Epigenetic Alterations): التغيرات في التعبير الجيني دون تغيير تسلسل الحمض النووي.
فقدان استقرار البروتينات (Loss of Proteostasis): ضعف قدرة الخلية على الحفاظ على سلامة البروتينات.
اختلال استشعار المغذيات (Deregulated Nutrient Sensing): اضطراب في كيفية استجابة الخلية للمغذيات.
خلل وظيفي في الميتوكوندريا (Mitochondrial Dysfunction): ضعف في محطات الطاقة الخلوية.
شيخوخة الخلايا (Cellular Senescence): تراكم الخلايا التي توقفت عن الانقسام وأصبحت تفرز مواد ضارة.
استنزاف الخلايا الجذعية (Stem Cell Exhaustion): نقص في قدرة الأنسجة على التجدد.
تغير التواصل بين الخلايا (Altered Intercellular Communication): اضطراب في الإشارات بين الخلايا.
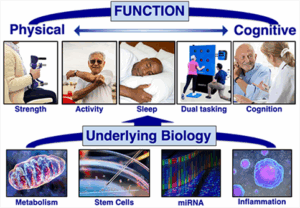
هذه الاكتشافات مهدت الطريق لتطوير أدوية تستهدف هذه المسارات، مما أدى إلى ظهور مجال علمي جديد يُعرف بـ “geroscience”، وهو العلم الذي يهتم بدراسة الشيخوخة وتطوير التدخلات لإبطائها.
أهم المراحل والأبحاث والدراسات البارزة
شهدت العقود الأخيرة طفرة في البحث عن مركبات تستهدف مسارات الشيخوخة. إليك أبرز المراحل والمركبات التي حظيت باهتمام كبير:
1. الكبح الغذائي (Caloric Restriction – CR)
يُعتبر الكبح الغذائي، وهو تقليل السعرات الحرارية المتناولة دون نقص غذائي، أحد أكثر التدخلات الواعدة والمدروسة جيدًا لإطالة العمر. أظهرت الدراسات على مجموعة واسعة من الكائنات الحية، من الخميرة إلى الرئيسيات، أن تقليل السعرات الحرارية يطيل العمر ويحسن الصحة. كان هذا الاكتشاف حجر الزاوية في فهم أن المسارات الأيضية تلعب دوراً حاسماً في الشيخوخة.
التحدي: على الرغم من فعاليته، فإن الالتزام الصارم بالكبح الغذائي صعب على البشر، مما دفع الباحثين للبحث عن “محاكيات الكبح الغذائي” (Caloric Restriction Mimetics) التي يمكن أن تحقق نفس الفوائد دون الحاجة إلى تقليل السعرات الحرارية.
2. الرابامايسين (Rapamycin) (sirulimus)
حالياً، يستخدم كدواء مثبط للمناعة لمنع رفض الأعضاء بعد الزراعة.
أهميته في إطالة العمر: في أوائل العقد الأول من القرن الحادي والعشرين، أظهرت الدراسات على الفئران أن الرابامايسين يطيل العمر بشكل ملحوظ ويعالج العديد من الأمراض المرتبطة بالعمر. يعمل الرابامايسين عن طريق تثبيط مركب يسمى mTOR) (mammalian Target of Rapamycin))، وهو منظم رئيسي للنمو الخلوي والأيض والاستجابة للمغذيات. يُعتقد أن تثبيط (mTOR) يحاكي جوانب من الكبح الغذائي.
التحديات والآفاق: بينما أظهر الرابامايسين نتائج واعدة جدًا في نماذج حيوانية، فإن استخدامه في البشر لأغراض إطالة العمر لا يزال قيد البحث بسبب آثاره الجانبية المحتملة كمثبط للمناعة. ومع ذلك، تُجرى دراسات سريرية صغيرة لاستكشاف تأثيره على بعض سمات الشيخوخة لدى البشر.
3. الميتفورمين (Metformin)
الميتفورمين هو دواء شائع لعلاج السكري من النوع 2، ويعود استخدامه إلى الخمسينيات.
أهميته في إطالة العمر: لوحظ أن مرضى السكري الذين يتناولون الميتفورمين يعيشون لفترة أطول ولديهم معدلات أقل للإصابة ببعض أنواع السرطان وأمراض القلب مقارنة بغير المصابين بالسكري. يعمل الميتفورمين بطرق متعددة، بما في ذلك تنشيط إنزيم AMPK) (AMP-activated protein kinase))، وهو مستشعر للطاقة الخلوية يلعب دورًا في الأيض والشيخوخة.
الدراسات السريرية: يُعتبر الميتفورمين مرشحًا قويًا لدراسات إطالة العمر لدى البشر نظرًا لسلامته النسبية وتاريخه الطويل من الاستخدام. أهم مبادرة هي دراسة TAME) (Targeting Aging with Metformin))، وهي دراسة سريرية كبيرة تهدف إلى تحديد ما إذا كان الميتفورمين يمكن أن يؤخر أو يمنع ظهور الأمراض المرتبطة بالعمر لدى غير المصابين بالسكري.

4. منشطات بروتينات السيرتوينات (Sirtuins) (Resveratrol)
السيرتوينات هي عائلة من البروتينات التي تلعب أدوارًا حيوية في تنظيم الأيض، إصلاح الحمض النووي، والالتهاب، وقد وُجد أنها مرتبطة بطول العمر في الكائنات الحية المختلفة.
الريسفيراترول (Resveratrol): مركب موجود في العنب الأحمر، اكتسب شهرة كبيرة في أوائل العقد الأول من القرن الحادي والعشرين بعد أن أظهرت الأبحاث قدرته على تنشيط السيرتوينات (خاصة SIRT1) وإطالة عمر الخميرة وبعض الديدان.
التحديات: على الرغم من الإثارة الأولية، فإن الدراسات اللاحقة على الريسفيراترول في البشر كانت أقل إقناعاً، حيث لم تُظهر فوائد كبيرة أو القدرة على تنشيط السيرتوينات بنفس الفعالية التي شُوهدت في المختبر. ومع ذلك، لا تزال الأبحاث جارية لتطوير منشطات سيرتوينات أكثر فعالية واستقرارًا.
5. مثبطات الخلايا الهرمة (Senolytics)
الخلايا الهرمة (Senescent cells) هي خلايا توقفت عن الانقسام وتراكمت في الأنسجة مع تقدم العمر. هذه الخلايا تفرز مواد كيميائية ضارة تُعرف بـ “النمط الإفرازي المرتبط بالشيخوخة” (SASP)، مما يساهم في الالتهاب المزمن وتلف الأنسجة والأمراض المرتبطة بالعمر.
الأبحاث والدراسات: اكتشاف القدرة على إزالة هذه الخلايا الهرمة بشكل انتقائي يُعتبر طفرة. أظهرت الدراسات على الفئران أن إزالة الخلايا الهرمة باستخدام “أدوية السنوليتيك” (Senolytics) يمكن أن يؤخر أو يخفف من أمراض متعددة مرتبطة بالعمر مثل السكري، قصور القلب، والفشل الكلوي.
أمثلة على السنوليتيكس:
الكيرسيتين (Quercetin) والداساتينيب (Dasatinib): يُستخدم هذا المزيج في التجارب السريرية المبكرة.
* الفيسيتين (Fisetin): فلافونويد طبيعي.
الآفاق: أدوية السنوليتيك هي مجال بحث نشط للغاية، وهناك العديد من التجارب السريرية الجارية لاختبار سلامتها وفعاليتها في البشر لعلاج أمراض محددة مرتبطة بالعمر.
6. مثبطات الافرازات الضارة من الخلايا الهرمة السنومورفيك (Senomorphics)
بدلاً من قتل الخلايا الهرمة، تهدف مثبطات السنومورفيك إلى تعديل النمط الإفرازي للخلايا الهرمة (SASP) لتقليل الآثار الضارة دون الحاجة إلى إزالتها بالكامل. هذا النهج يقلل من المخاوف المتعلقة بالآثار الجانبية المحتملة لإزالة الخلايا.
7. مثبطات تحلل (NAD+):
الآلية: تعزز مستويات (NAD+)، وهو جزيء أساسي في إنتاج الطاقة الخلوية وإصلاح الحمض النووي.
الأمثلة: مركبات مثل NMN (Nicotinamide Mononucleotide) وNR (Nicotinamide Riboside) تُختبر حاليًا في تجارب سريرية.
الدراسات: أظهرت الدراسات على الحيوانات أن زيادة مستويات (NAD+) يمكن أن تحسن وظيفة الميتوكوندريا، وتبطئ الشيخوخة في الأنسجة المختلفة، وربما تزيد العمر. تُجرى الآن دراسات سريرية لاستكشاف آثار (NMN) و (NR) على صحة الإنسان، بما في ذلك وظيفة العضلات، حساسية الأنسولين، وصحة القلب والأوعية الدموية.
8. مثبطات (Interleukin-11):
الآلية: تقلل من الالتهابات المزمنة المرتبطة بالشيخوخة، مما يحسن الصحة العامة ويطيل العمر.
لا تزال في مرحلة التجارب الحيوانية، مع خطط لتجارب سريرية مستقبلية.
جهود المملكة العربية السعودية واستثماراتها في مجال إطالة العمر
في إطار رؤية 2030، التي تهدف إلى تنويع الاقتصاد وتعزيز جودة الحياة، اتخذت السعودية خطوات طموحة لتصبح رائدة عالميًا في مجال أبحاث إطالة العمر الصحي (Healthspan). أبرز هذه الجهود:
1. مؤسسة هيفوليشن (Hevolution Foundation):
أُطلقت في عام 2021 بقرار ملكي بقيادة ولي العهد الأمير محمد بن سلمان، وهي منظمة غير ربحية تهدف إلى تمويل أبحاث إطالة العمر الصحي بميزانية سنوية تصل إلى مليار دولار.
2. توطين صناعة الأدوية:
في يوليو 2025، أعلنت شركة “إيفركير” عن استثمار بقيمة مليوني دولار لتوطين وتصنيع أدوية إطالة العمر في السعودية، مثل (NAD+، CoQ10)، والأدوية الهرمونية، بالإضافة إلى المحاليل الوريدية والمكملات الغذائية.
تهدف هذه المبادرة إلى دعم الصحة الوقائية ورفع متوسط العمر المتوقع، بما يتماشى مع هدف رؤية 2030 بزيادة متوسط العمر من 74 إلى 80 عامًا بحلول 2030.
3. البحث والتطوير في التكنولوجيا الحيوية:
تدعم السعودية أبحاث الخلايا الجذعية والطب التجديدي من خلال مراكز مثل برنامج الخلايا الجذعية وإعادة هندسة الأنسجة في مستشفى الملك فيصل التخصصي.
4. برامج الصحة الوقائية والعافية:
تُركز السعودية على الوقاية من الأمراض المزمنة من خلال مراكز العافية التي تقدم تقييمات جينية، برامج التخلص من السموم، ومبادرات مكافحة الشيخوخة.
آخر المستجدات والتحديات
يشهد مجال علاجات إطالة العمر تطورات سريعة ومثيرة.:
1- تزايد الاستثمار: تستثمر شركات الأدوية الكبرى وشركات التكنولوجيا الحيوية الناشئة مبالغ ضخمة في هذا المجال، مما يعكس الثقة المتزايدة في إمكاناته.
2- تقنيات جديدة: استخدام الذكاء الاصطناعي (AI) والتعلم الآلي (Machine Learning) لتسريع اكتشاف المركبات واستهداف مسارات الشيخوخة.
3- الطب الدقيق للشيخوخة: يتجه البحث نحو “طب الشيخوخة الدقيق” (Precision Geroscience)، حيث يتم تصميم التدخلات بناءً على السمات البيولوجية الفردية للشيخوخة لكل شخص.
4- التركيز على “مدة الصحة” (Healthspan): لم يعد الهدف الوحيد هو إطالة العمر، بل الأهم هو إطالة الفترة التي يعيش فيها الإنسان بصحة جيدة ونوعية حياة عالية.
5- التجارب السريرية على البشر: تزايد عدد التجارب السريرية التي تختبر أدوية إطالة العمر المحتملة على البشر، مما ينقل البحث من المختبر إلى التطبيق.

التحديات التي تواجه علاجات الشيخوخة:
1. التعريف التنظيمي للشيخوخة: لا تُصنف الشيخوخة حالياً كمرض من قبل الهيئات التنظيمية مثل إدارة الغذاء والدواء الأمريكية (FDA). هذا يجعل الموافقة على الأدوية التي تستهدف الشيخوخة نفسها (بدلاً من الأمراض الفردية المرتبطة بالشيخوخة) أمرًا معقدًا.
2. مدة التجارب السريرية: تتطلب دراسات إطالة العمر على البشر فترات زمنية طويلة جدًا (عقود) لرؤية التأثير على العمر كله، مما يجعلها باهظة التكلفة وصعبة التنفيذ. لذا، تُركز الدراسات حالياً على “النقاط النهائية البديلة” (Surrogate Endpoints) مثل المؤشرات الحيوية للشيخوخة أو الوقاية من الأمراض المرتبطة بالعمر.
3. الآثار الجانبية غير المتوقعة: قد يكون للتأثير على مسارات بيولوجية أساسية في الشيخوخة عواقب غير مقصودة أو آثار جانبية على المدى الطويل.
4. الأخلاقيات والمساواة: تثير القدرة على إطالة العمر أسئلة أخلاقية واجتماعية عميقة، مثل من سيتمكن من الوصول إلى هذه الأدوية، وتأثيرها على التركيبة السكانية، والموارد.
5. فهم التفاعلات المعقدة: مسارات الشيخوخة متشابكة ومعقدة للغاية. قد يؤدي استهداف مسار واحد إلى تغييرات في مسارات أخرى بطرق غير متوقعة.
في الختام،،،
تعتبر أدوية إطالة العمر مجالاً علمياً سريع التطور وواعداً للغاية، يحمل القدرة على تغيير كيفية تعاملنا مع الشيخوخة والأمراض المرتبطة بها. على الرغم من التحديات الكبيرة التي تواجه هذا المجال، فإن التقدم المستمر في فهم بيولوجيا الشيخوخة، وتطور تقنيات البحث، وزيادة الاستثمار، كلها تشير إلى مستقبل مشرق.
من المرجح أن نشهد في العقود القادمة ظهور أدوية قادرة على إبطاء الشيخوخة وتحسين الصحة العامة، مما سيؤدي إلى ثورة حقيقية في الطب وطول العمر البشري. ومع ذلك، من الضروري المضي قدمًا بحذر، مع التركيز على السلامة والفعالية والاعتبارات الأخلاقية لضمان أن هذه التطورات تفيد البشرية جمعاء.

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية

موضوع شيق جدا بارك الله فيك د. غسان
مقال علمي و تحليلي جميل و اسلوب نصي راقي شكرا جزيلا
بحث جدا شيق ورائع ومفيد ونشكرك الشكر الجزيل على هذا البحث المفيد