Scientists Reverse the Aging Clock: Restore Age-Related Vision Loss Through Epigenetic Reprogramming (كلية الطب بجامعة هارفارد)

ملخص:
- تمثل دراسة إثبات المفهوم (Proof-of-concept) أول محاولة ناجحة لعكس ساعة الشيخوخة في الحيوانات من خلال إعادة البرمجة اللاجينية.
- قام العلماء بتشغيل الجينات الجنينية لإعادة برمجة خلايا شبكية عين الفئران.
- عكس هذا النهج أضرار العين التي يسببها الجلوكوما في الحيوانات.
- أعاد هذا النهج أيضًا فقدان البصر المرتبط بالعمر لدى الفئران المسنة.
- يعِدُ العمل باستخدام نفس النهج في الأنسجة الأخرى، الأعضاء الأخرى غير العين.
- النجاح يمهد الطريق لعلاج مختلف الأمراض المرتبطة بالعمر لدى الإنسان.
نجح علماء كلية الطب بجامعة هارفارد في استعادة الرؤية لدى الفئران من خلال إعادة عقارب الساعة إلى الوراء على خلايا العين المسنة في شبكية العين لاستعادة وظيفة الجينات الشابة.
ويمثل عمل الفريق، الموصوف بيوم (2 ديسمبر 2020) في نشرة نيتشر (Nature) ، أول دليل على أنه قد يكون من الممكن إعادة برمجة الأنسجة المعقدة بأمان – مثل الخلايا العصبية للعين – إلى عمر مبكر. فبالإضافة إلى إعادة ضبط ساعة شيخوخة الخلايا، نجح الباحثون في عكس فقدان البصر لدى الحيوانات التي تعاني من حالة تحاكي الجلوكوما البشرية، وهي سبب رئيسي للعمى في جميع أنحاء العالم.
وذكر الفريق أن هذا الإنجاز يمثل أول محاولة ناجحة لعكس فقدان البصر الناجم عن الجلوكوما، بدلاً من مجرد وقف تقدمه. وإذا تم تكرار هذا النهج من خلال مزيد من الدراسات، فيمكن أن يمهد هذا النهج الطريق للعلاجات لتعزيز إصلاح الأنسجة عبر مختلف الأعضاء وعكس الشيخوخة والأمراض المرتبطة بالعمر لدى البشر.
“توضح دراستنا أنه من الممكن عكس عمر الأنسجة المعقدة بأمان مثل شبكية العين واستعادة وظيفتها البيولوجية الشابة” ، قال البروفيسور ديفيد سينكلير، كبير مؤلفي الورقة العلمية المنشورة، أستاذ علم الوراثة في معهد بلافاتنيك بكلية الطب بجامعة هارفارد والمدير المشارك لمركز باول ف. غلين لبيولوجيا أبحاث الشيخوخة في كلية الطب بجامعة هارفارد وخبير في الشيخوخة.
ويحذر البروفيسور سينكلير وزملاؤه من أن النتائج لا تزال بحاجة إلى تكرار في دراسات أخرى، بما في ذلك في نماذج حيوانية مختلفة، قبل أي تجارب بشرية. ومع ذلك، يضيفون أن النتائج تقدم دليلاً على المفهوم ومسارًا لتصميم علاجات لمجموعة من الأمراض البشرية المرتبطة بالعمر. وقال: “إذا أكدت من خلال مزيد من الدراسات، يمكن أن تكون هذه النتائج تحويلية للعناية بأمراض الرؤية المرتبطة بالعمر مثل الجلوكوما وفي مجالات البيولوجيا والعلاجات الطبية للأمراض بشكل عام”.
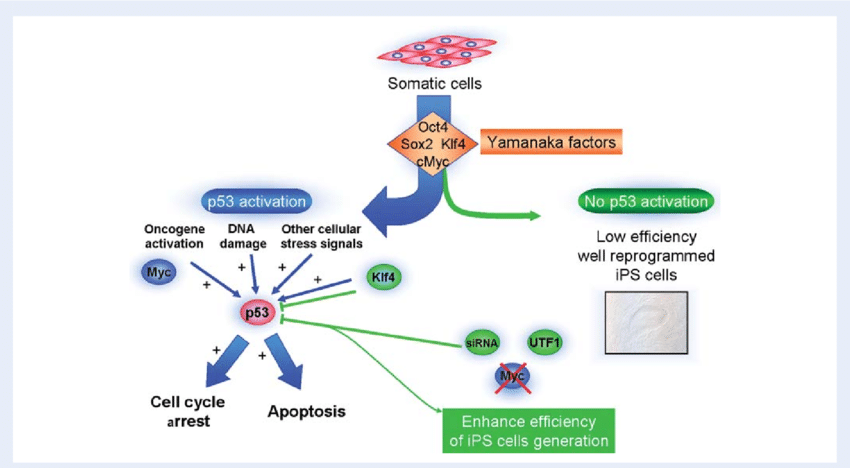
وقد استخدم الفريق لعملهم فيروسًا مرتبطًا بالغدة (Adeno-associated Virus – AAV) كوسيلة لإيصال ثلاثة جينات لاستعادة الشباب إلى شبكية عين الفئران – Oct4 و Sox2 و Klf4 – والتي يتم تشغيلها عادةً أثناء التطور الجنيني. وتُعرف هذه الجينات الثلاثة، جنبًا إلى جنب مع جين رابع لم يُستخدم في هذا العمل، مجتمعة باسم عوامل ياماناكا (Yamanaka factors).
وكان للعلاج آثار مفيدة متعددة على العين. فأولًا، شجع على تجديد الأعصاب بعد إصابة العصب البصري في الفئران المصابة بأعصاب بصرية تالفة. وثانيًا، عكس فقدان البصر لدى الحيوانات المصابة بحالة تشبه الجلوكوما البشرية. وثالثًا، عكس فقدان البصر لدى الحيوانات المسنة التي لا تعاني من الجلوكوما.
ويعتمد نهج الفريق على نظرية جديدة حول سبب تقدمنا في العمر. فمعظم الخلايا في الجسم تحتوي على نفس جزيئات الحمض النووي ولكن لها وظائف متنوعة على نطاق واسع. ولتحقيق هذه الدرجة من التخصص، يجب على هذه الخلايا قراءة الجينات الخاصة بنوعها فقط. وهذه الوظيفة التنظيمية هي من اختصاص الإبيجينوم، وهو نظام لتشغيل الجينات وإيقافها في أنماط محددة دون تغيير تسلسل الحمض النووي الأساسي للجين.
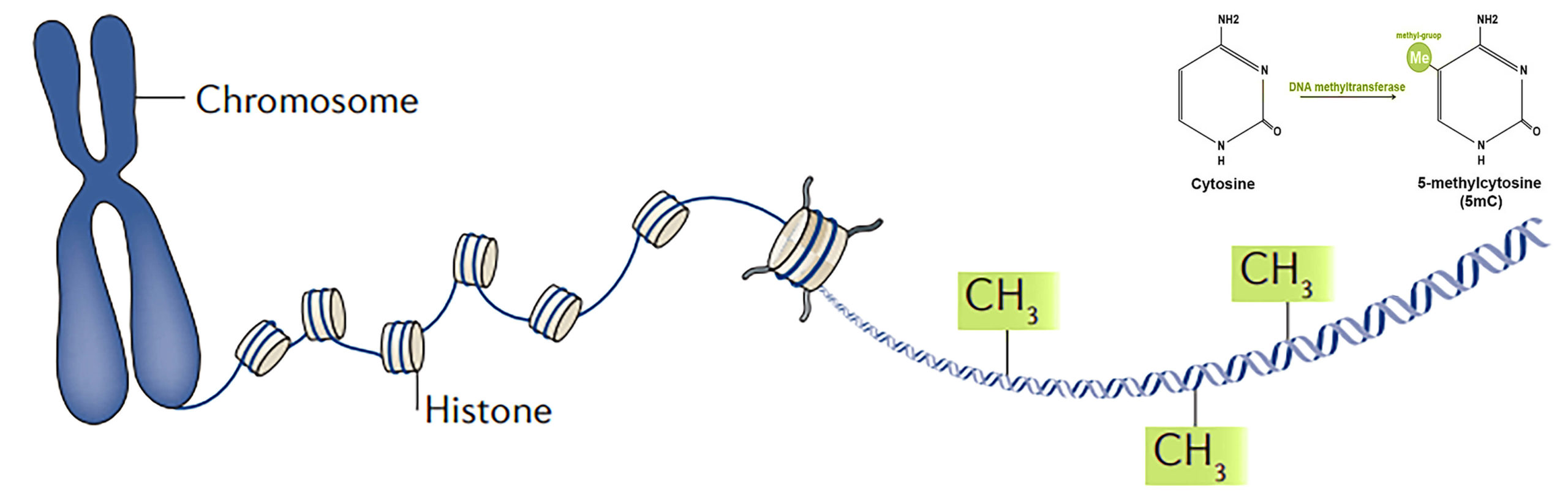
وتفترض هذه النظرية أن التغييرات التي تطرأ على الإيبيجينوم بمرور الوقت تجعل الخلايا تقرأ الجينات الخاطئة وتؤدي إلى حدوث خلل وظيفي – مما يؤدي إلى ظهور أمراض الشيخوخة. وأحد أهم التغييرات التي تطرأ على الإيبيجينوم هو مثيلة الحمض النووي (DNA methylation) [١]، وهي عملية يتم من خلالها ربط مجموعات الميثيل بالحمض النووي. يتم وضع أنماط مثيلة الحمض النووي أثناء التطور الجنيني لإنتاج أنواع الخلايا المختلفة. بمرور الوقت ، تُفقد الأنماط الفتية من مثيلة الحمض النووي ، وتتوقف الجينات داخل الخلايا التي يجب تشغيلها ، والعكس صحيح ، مما يؤدي إلى ضعف الوظيفة الخلوية. يمكن التنبؤ ببعض تغييرات مثيلة الحمض النووي هذه وقد تم استخدامها لتحديد العمر البيولوجي للخلية أو الأنسجة.
ومع ذلك ، فقد ظل غير واضح ما إذا كانت مثيلة الحمض النووي تسبب التغيرات المرتبطة بالعمر داخل الخلايا. وافترض الباحثون في الدراسة الحالية أنه إذا كانت مثيلة الحمض النووي تتحكم بالفعل في الشيخوخة، فإن محو بعض آثارها قد يعكس عمر الخلايا داخل الكائنات الحية ويعيدها إلى حالتها المبكرة الأكثر شبابًا.
وقد حقق العمل السابق هذا الإنجاز في الخلايا التي نمت في أطباق المختبر، لكنه فشل في إثبات التأثير على الكائنات الحية. وتظهر النتائج الجديدة أنه يمكن استخدام هذا النهج في الحيوانات أيضًا.
التغلب على عقبة مهمة
طور مؤلف الدراسة الرئيسي يوانتشينغ لو (Yuancheng Lu) ، الزميل الباحث في علم الوراثة في كلية الطب بجامعة هارفارد وطالب دكتوراه سابق في مختبر سنكلير (Sinclair) ، علاجًا جينيًا يمكنه عكس عمر الخلايا بأمان في حيوان حي.
ويعتمد عمل الدكتور لو على الاكتشاف الحائز على جائزة نوبل للبروفيسور شينيا ياماناكا (Shinya Yamanaka) [٢]، الذي حدد عوامل النسخ الأربعة : Oct4، Sox2 ، Klf4 ، c-Myc ، التي يمكنها محو علامات التخلق المتوالي على الخلايا وإعادة هذه الخلايا إلى حالتها الجنينية البدائية التي يمكنها من خلالها أن تتطور إلى أي نوع آخر من الخلايا.
ولكن الدراسات اللاحقة أظهرت انتكاستين مهمتين. أولاً، عند استخدامها في الفئران البالغة ، يمكن أن تؤدي عوامل يامانكا (Yamanaka factors) الأربعة أيضًا إلى نمو الورم، مما يجعل هذا النهج غير آمن. وثانيًا، يمكن للعوامل إعادة ضبط الحالة الخلوية إلى حالة الخلية الأكثر بدائية، وبالتالي محو هوية الخلية تمامًا.
وقد تجاوز الدكتور لو وزملاؤه هذه العقبات من خلال تعديل طفيف في النهج، حيث أسقطوا الجين c-Myc وسلموا فقط جينات ياماناكا الثلاثة المتبقية Oct4 ، Sox2 و Klf4. ونجح النهج المعدل في عكس شيخوخة الخلايا دون تأجيج نمو الورم أو فقدان هويتها.
العلاج الجيني المطبق على تجديد العصب البصري
استهدف الباحثون في الدراسة الحالية خلايا الجهاز العصبي المركزي لأنها الجزء الأول من الجسم الذي يتأثر بالشيخوخة. فبعد الولادة، تتراجع قدرة الجهاز العصبي المركزي على التجدد بسرعة.
ولاختبار ما إذا كان يمكن نقل القدرة التجديدية للحيوانات الصغيرة إلى الفئران البالغة، قام الباحثون بتسليم تركيبة معدلة من ثلاثة جينات عبر فيروس مرتبط بالغدة (AAV) إلى خلايا العقدة الشبكية للفئران البالغة التي تعاني من الإصابة في العصب البصري. ومن أجل هذا العمل، تعاون الدكتور لو والبروفيسور سينكلير مع البروفيسور زيغانغ هي (Zhigang He)، أستاذ طب الأعصاب وطب العيون في مستشفى بوسطن للأطفال، الذي يَدْرُس تجديد العصب البصري والحبل الشوكي.
ونتج عن العلاج زيادة مضاعفة في عدد الخلايا العقدية الشبكية الباقية على قيد الحياة بعد الإصابة وزيادة في نمو العصب بمقدار خمسة أضعاف. وقال الدكتور لو: “في بداية هذا المشروع، قال العديد من زملائنا إن نهجنا سيفشل أو سيكون خطيرًا للغاية بحيث لا يمكن استخدامه على الإطلاق” ، وأضاف: “تشير نتائجنا إلى أن هذه الطريقة آمنة ويمكن أن تحدث ثورة في علاج العين والعديد من الأعضاء الأخرى التي تتأثر بالشيخوخة”.
عكس الجلوكوما وفقدان البصر المرتبط بالعمر
بعد النتائج المشجعة في الفئران التي تعاني من إصابات في العصب البصري، دخل الفريق في شراكة مع زملائه: بروس كساندر من معهد شيبنز لأبحاث العيون في مستشفى ماساتشوستس للعين والأذن، الأستاذ المساعد لطب العيون في كلية الطب في جامعة ماساتشوستس؛ وميريديث جريجوري-كساندر، الأستاذ المساعد لطب العيون في كلية الطب في جامعة ماساتشوستس. وقد خططوا لمجموعتين من التجارب: واحدة لاختبار ما إذا كان المزيج ثلاثي الجينات يمكن أن يستعيد فقدان البصر بسبب الجلوكوما والأخرى لمعرفة ما إذا كان هذا النهج يمكن أن يعكس فقدان البصر الناجم عن الشيخوخة الطبيعية.
وأدى العلاج في نموذج الفئران المصابة بالجلوكوما إلى زيادة النشاط الكهربائي للخلايا العصبية وزيادة ملحوظة في حدة البصر، كما تم قياسها من خلال قدرة الحيوانات على رؤية الخطوط العمودية المتحركة على الشاشة. ومن اللافت للنظر أنها فعلت ذلك بعد أن حدث بالفعل فقدان الرؤية الناجم عن الجلوكوما.
وقال البروفيسور كساندر: “نادرًا ما أظهر العلماء استعادة الوظيفة البصرية بعد الإصابة” ، مضيفًا: “هذا النهج الجديد، الذي نجح في عكس الأسباب المتعددة لفقدان البصر لدى الفئران دون الحاجة إلى زراعة الشبكية، يمثل طريقة علاج جديدة في الطب التجديدي”.
ونجح العلاج بالمثل في الفئران المسنة البالغة من العمر 12 شهرًا والتي تعاني من ضعف في الرؤية بسبب الشيخوخة الطبيعية. فبعد علاج الفئران المسنة، كانت أنماط التعبير الجيني والإشارات الكهربائية لخلايا العصب البصري مماثلة للفئران الصغيرة، وتم استعادة الرؤية. وعندما حلل الباحثون التغيرات الجزيئية في الخلايا المعالجة، وجدوا أنماطًا معكوسة لمثيلة الحمض النووي – وهي ملاحظة تشير إلى أن مثيلة الحمض النووي ليست مجرد علامة أو متفرج في عملية الشيخوخة، بل عامل نشط يقودها.
وقال سنكلير: “ما يخبرنا به هذا هو أن الساعة لا تمثل الوقت فقط – لقد حان الوقت” ، وتابع: “إذا أعدت عقارب الساعة للوراء، فسيعود الوقت أيضًا إلى الوراء”.
وقال الباحثون إنه إذا تم تأكيد النتائج التي توصلوا إليها في مزيد من العمل على الحيوانات، فيمكنهم بدء تجارب سريرية في غضون عامين لاختبار فعالية هذا النهج في الأشخاص المصابين بمرض الجلوكوما. وأضافوا إن النتائج مشجعة حتى الآن. ففي الدراسة الحالية، لم تظهر أي آثار جانبية سلبية على علاج الفئران باستخدام نهج ثلاثي الجينات لمدة عام كامل.
*تمت الترجمة بتصرف
المرجع: مجلة نيتشر (Nature) ، عدد ٢ ديسمبر ٢٠٢٠ DOI: 10.1038/s41586-020-2975-4
معلومات إضافية:
[أ] مؤلفو الورقة العلمية الآخرون هم: بنديكت برومر، شياو تيان، أنيثا كريشنان، مارجريتا مير، تشين وانغ، دانيال فيرا، كيوروي زينج ، دودو يو، مايكل بونكوسكي، جاي هيون يانغ، سونغلين زهو، إيما هوفمان، مارجريت كارج، مايكل شولتز، أليس كين، نوح دافيدسون، إيكاترينا كوروبكينا، كارولينا تشوالك، لويس راجمان، جورج تشيرش، كونراد هوشيدلينجر، فاديم غلاديشيف، ستيف هورفاث، ومورجان ليفين.
[ب] تم دعم هذا العمل جزئيًا من خلال منحة التنمية والتكوين في كلية الطب بجامعة هارفارد، ومؤسسة جلين للأبحاث الطبية، وإدوارد شولاك، والمعاهد الوطنية للصحة (منح: R01AG019719 R37AG028730 ، R01EY026939 ، R01EY021526 ، R01AG067782 ، R01GM0650254 ، R01AG067782 ، R01GM0650254 ، ، R24EY028767 و R21EY030276) ، ومؤسسة سانت فنسنت دي بول.
[ج] الإفصاحات ذات الصلة: ديفيد سنكلير (David Sinclair) هو مستشار ومخترع لبراءات الاختراع المرخصة وعضو مجلس إدارة ومالك الأسهم في ادونا ثيراباتك (Iduna Therapeutics)، وهي شركة لايف بايوساينس (Life Biosciences) تطور علاجات إعادة البرمجة اللاجينية، ومستشار غير مدفوع الأجر لشركة زيمو ريسيرنش (Zymo Research) وهي شركة أدوات وراثية. يوانتشنغ لو (Yuancheng Lu) ولويس رجمان (Luis Rajman) وستيف هورفاث (Steve Horvath) هم أصحاب الأسهم في ادونا ثيراباتك. جورج تشيرش ونوح دافيدسون من مؤسسي ريجوفينيت بايو (Rejuvenate Bio).
الهوامش:
[١] مثيلة الحمض النووي (DNA methylation) هي عملية بيولوجية يتم من خلالها إضافة مجموعات الميثيل إلى جزيء الحمض النووي. ويمكن أن تغير المثيلة نشاط جزء من الحمض النووي دون تغيير التسلسل، وتعمل مثيلة الحمض النووي عادةً على قمع نسخ الجينات عندما توجد في محفز جيني. ويكيبيديا
[٢] شينيا ياماناكا (Shinya Yamanaka) ، المولود في 4 سبتمبر 1962، هو باحث ياباني في مجال الخلايا الجذعية، وحائز على جائزة نوبل، يشغل منصب مدير مركز أبحاث الخلايا الجذعية المستحثة متعددة القدرات (induced Pluripotent Stem Cell – iPS) وتطبيقها، وأستاذًا في معهد العلوم الطبية الحدودية بجامعة كيوتو؛ محقق كبير في معاهد جيه ديفيد جلادستون التابعة لجامعة كاليفورنيا في سان فرانسيسكو (UCSF)، كاليفورنيا ؛ وأستاذ التشريح بجامعة كاليفورنيا، سان فرانسيسكو (UCSF). وهو أيضًا الرئيس السابق للجمعية الدولية لأبحاث الخلايا الجذعية (ISSCR). ويكيبيديا
 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية
