Novel insights on cellular suicide could provide new avenues for cancer therapies
(بقلم: هاريسون تاسوف (جامعة كاليفورنيا) – Harrison Tasoff , University of California – Santa Barbara)
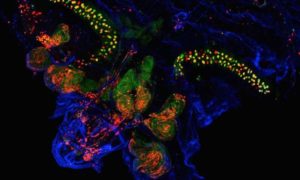
عندما يتعلق الأمر بالحياة المعقدة – حياة التنوع متعدد الخلايا – يمكن أن يكون موت الخلايا بنفس أهمية البقاء على قيد الحياة، اذ يسمح للكائنات بتنظيف “المنزل” ومنع تكاثر الخلايا التالفة التي قد تضر بوظيفة الأنسجة.
قبل عدة سنوات، اكتشفت عالمة الأحياء دينيس مونتيل – الأستاذ المتميز في قسم البيولوجيا الجزيئية والخلوية والتنموية بجامعة كاليفورنيا بسانتا باربرا – أن الخلايا تنجو أحيانًا، بعد ما كان يعتبر خطوة حاسمة في الانتحار الخلوي. وقد حددت – الآن – هي ومختبرها عاملين رئيسيين منهمكين في هذا التعافي الرائع.
وتشير النتائج، التي نُشرت في نايتشر كوميونيكيشنز (Nature Communications) ، إلى أن آلية البقاء هذه قد تكون حاسمة لاستعادة الأنسجة الطبيعية من الإجهاد الشديد بدلاً من حدوث صدفة. ويمكن أن يوفر فهم الفروق الدقيقة أيضًا استراتيجيات جديدة لعلاج السرطانات.
إن موت الخلايا المبرمج هو الطريقة الأكثر شيوعًا لانتحار الخلايا، وهذه العملية مهمة في الحفاظ على رفاهية الكائن الحي. وتحتاج الكائنات الحية إلى طريقة لإنهاء الخلايا عندما تُصاب بجروح بالغة أو يتلف حمضها النووي. كما يعد موت الخلايا المبرمج أيضًا جزءًا من معدل الدوران الطبيعي، خاصة في خلايا الدم وخلايا الجلد وبطانة الأمعاء. وقالت البروفيسور مونتيل: “قبل عملنا، اعتقد الناس حقًا أن موت الخلايا المبرمج كان قرارًا إما بالكل أو لا شيء، فإما أن تكون قد انتحرتَ واستمررتَ في ذلك، أو لم تفعل”.
واعتبر العلماء أن تنشيط إنزيم يسمى بشكل مناسب “كاسبيس [١] الجلاد” (executioner Caspase) هو نقطة اللاعودة. ويقوم هذا الإنزيم بشكل أساسي بتجزئة العديد من بروتينات الخلية وتقطيعها. ولكن اتضح أن موت الخلايا المبرمج أكثر دقة مما كان معروفًا في السابق، وفي بعض الأحيان تنجو الخلايا من كاسبيس الجلاد عبر عملية أخرى – اناستاسيس [٢] (anastasis). {“عملية اناستاسيس تعني: التعافي الخلوي من حافة الموت المبرمج”}.
العودة من حافة الهاوية
لفتت هذه الظاهرة انتباه البروفيسور مونتيل لأول مرة في عام 2010. وبشكل عام، يستخدم العلماء الذين يدرسون موت الخلايا المبرمج ظروفًا قاسية تؤدي إلى موت جميع الخلايا في عيّنتهم. وكان طالب دكتوراه في مختبر البروفيسور مونتيل، في ذلك الوقت، يشعر بالفضول بشأن ما إذا كانت الخلايا يمكنها البقاء على قيد الحياة عند تنشيط الكاسباس إذا أزال المادة التي تسببت في موت الخلايا المبرمج. ولدهشة الجميع، فعل الكثير منهم ذلك. منذ ذلك الحين، لاحظ العلماء وجود أناستاسيس في خلايا من العديد من الكائنات الحية المختلفة، بما في ذلك البشر والفئران وذباب الفاكهة. وقررت البروفيسور مونتيل وفريقها البحث عن الجينات التي من شأنها إما أن تعزز أو تمنع قدرة الخلايا على الخضوع لهذه العملية.
وتحقيقا لهذه الغاية، طبق الباحثون تقنية طوروها في عام 2016. فمن خلال تربية ذباب الفاكهة المعدلة وراثيا التي تعبر عن بروتين معين يتم قطعه بواسطة كاسبايس الجلاد، بدأوا سلسلة من الأحداث التي تجعل الخلايا في النهاية تتألق باللون الأخضر. ويحدد هذا بشكل دائم أي خلية نجت خلال هذه المرحلة من موت الخلايا المبرمج.
مع وجود هذه الأداة في متناول اليد، بدأ الفريق بقيادة زميلة ما بعد الدكتوراه السابق غونغبنغ صن (Gongping Sun) ، لتحديد الجينات المشاركة في اناستاسيس. ونظرًا لعدم تمكنهم من التحقيق في جميع الجينات البالغ عددها 13000 في جينوم ذبابة الفاكهة، قام الباحثون بتمشيط بياناتهم الخاصة وكذلك الأدبيات لتحديد الجينات المرشحة، واستقروا في النهاية على حوالي 200 جين لمزيد من البحث. وأخذت الدكتورة صن وزملاؤها في المعمل مئات من ذباب الفاكهة وأوقفوا التعبير عن جين مختلف في نصف خلايا كل حيوان. وقد مكنهم هذا من التحكم في العوامل الأخرى التي قد تؤثر على النتائج.
في الورقة البحثية التي نُشرت في عام 2016 ، وجد الفريق أن بعض الخلايا تخضع لتأثير اناستاسيس أثناء التطور الطبيعي لذبابة الفاكهة. وفي الورقة الجديدة، بحثوا عن التغييرات في النسبة المئوية للخلايا التي مرت بهذه العملية أثناء التطور. كما قاموا أيضًا باختبار الجينات لقدرتها على التأثير على أناستاسيس استجابةً لضغوط مثل الإشعاع والحرارة. وكان التمييز بين الجينات المتضمنة في أناستاسيس وتلك الضرورية للبقاء على قيد الحياة تحديًا. وقالت البروفيسور مونتيل: “لأنه إذا كان ذلك ضروريًا للبقاء فترة، فسيكون أيضًا ضروريًا للتعافي من حافة الموت”.
ولذلك، نظر الفريق ليس فقط في عدد الخلايا المتوهجة في عينة باللون الأخضر بعد التجربة، ولكن أيضًا في نسبة الخلايا الخضراء إلى الخلايا غير الخضراء. إذا كان الجين المعني ضروريًا للبقاء الأساسي، ولكنه غير مشارك في أناستاسيس، فإنه يؤثر على جميع الخلايا بالتساوي، ما سيؤثر على العدد الإجمالي للخلايا الفلورية، لكنه يترك النسبة دون تغيير.
وقد جد الباحثون بروتينين، والجينات التي تم ترميزها لهما، وكانا ذوي أثر في أناستاسيس. الأول هو ايه كي تي ١ (AKT1) ، وهو بروتين بقاء مشهور ومدروس جيدًا يتم تنشيطه استجابة لعوامل النمو، وبشكل أساسي يخبر الخلية بالنمو والانقسام. وكان العلماء يدركون أن هذا البروتين يمكن أن يمنع تنشيط كاسبايس الجلاد، لكن الفريق اكتشف أنه يمكن أيضًا أن يحدث فرقًا بين البقاء والموت بعد تشغيل كاسبايس.
البروتين الآخر هو سي آي زي ١ (CIZ1) ، الذي لم تتم دراسته جيدًا، وظهر في عدد من الأوراق غير ذات الصلة عبر الأدبيات. وفي جميع هذه الحالات تقريبًا، يبدو أن هذا البروتين يعزز أيضًا البقاء على قيد الحياة عند الإجهاد. فعلى سبيل المثال، يرتبط انخفاض كمية هذا البروتين بزيادة التنكس العصبي المعتمد على العمر في الفئران.
ويشير ارتباط هذين البروتينين في اناستاسيس إلى أنها على الأرجح عملية قديمة جدًا. وقالت البروفيسور مونتيل: “ليست ظاهرة تعافي الخلايا من شفاء الموت فحسب، بل حتى الآلية – الجزيئات المعنية – محفوظة بعمق في التطور لدرجة أن الذباب والفئران تستخدم نفس الجزيئات”.
موت الخلايا المبرمج ومحاربة السرطان
هذه النتائج هي خطوة كبيرة إلى الأمام في فهم موت الخلايا المبرمج على المستوى الأساسي، وتقترح ايضا التطبيقات الممكنة – خصوصًا في الجهود المبذولة لمكافحة السرطان. ويخدم موت الخلايا المبرمج وظيفة مهمة في الحفاظ على توازن مستقر داخل الكائنات الحية المعقدة. ففي الظروف العادية – مثل اتلاف الأشعة فوق البنفسجية لخلية الجلد – يريد الجسم أن تموت الخلية المصابة حتى لا تتطور إلى حالة مثل سرطان الجلد (melanoma).
وقالت البروفيسور مونتيل: “مع ذلك، إذا تعرضتَ لضغط شديد، فقد لا ترغب في أن ترتكب كل خلية موت الخلايا المبرمج، فقد يؤدي ذلك إلى تلف دائم في الأنسجة يكون من الصعب للغاية التعافي منه”.
واستجابةً للصدمة الشديدة ولكن المؤقتة، قد يكون من المفيد لبعض الخلايا أن تكون قادرة على الارتداد. وتشك البروفيسور مونتيل في أن هذا هو السبب الرئيسي وراء تطوير الكائنات الحية لطريقة للتحايل على موت الخلايا المبرمج.
ويبدو أن الطبيعة المؤقتة للإجهاد هي العامل الحاسم في كل من الدور الذي يلعبه اناستاسيس في تعزيز الشفاء وفي الآلية نفسها. فعندما تكون الخلية تحت ضغط شديد، مثل الإشعاع أو التعرض للمواد الكيميائية، يحدث شيئان في وقت واحد: تنشط الخلية استجابة موت الخلايا المبرمج – بما في ذلك كاسبايس الجلاد – بينما تنشط أيضًا الاستجابات المؤيدة للبقاء. وقالت البروفيسور مونتيل: “الأمر يشبه وضع دواسة الوقود والفرامل في نفس الوقت”.
وتعزز عوامل موت الخلايا المبرمج نفسها، لذلك إذا استمرت الظروف المجهدة، فإن العملية تتجاوز العتبة وتموت الخلية. ولكن إذا كان الضغط عابرًا فقط، فإن المسار المؤيد للبقاء جاهز بالفعل للركض ومساعدة الخلية على التعافي. ولا يفهم الباحثون تمامًا كيف تقوم الخلية بإيقاف مسار موت الخلايا المبرمج، ولكن من المحتمل أن تشارك بروتينات مثل ايه كي تي ١ (AKT1) و سي آي زي ١ (CIZ1).
ومع ذلك، هناك جانب مظلم لآلية البقاء هذه. وأشارت الروفيسور مونتيل إلى أن “أناستاسيس يمكن أن يكون شيئًا جيدًا إذا كنت تحاول إصلاح الأنسجة التالفة، ولكن قد يكون أمرًا سيئًا لأنه قد يعزز نمو الأورام، خاصةً في الاستجابةً للعلاج الكيميائي والعلاج الإشعاعي، وهي ضغوط مؤقتة شديدة”. وأوضحت أن هذا يتوافق مع خبرة العديد من الأطباء. ويستجيب الكثير من مرضى السرطان للعلاج بشكل جيد في البداية ؛ تتقلص أورامهم وتتحسن حالتهم. لكن لسوء الحظ، غالبًا ما تنمو الأورام مرة أخرى، والعلماء ليسوا متأكدين من سبب ذلك.
ويعتقد البعض أن عودة الظهور قد تكون نتيجة للخلايا المقاومة للأدوية الموجودة في الورم، والتي بدورها تؤدي إلى الانتكاس. وتقدم هذه الورقة العلمية فرضية أخرى، كما قالت البروفيسور مونتيل: “فكرة أن العلاج نفسه يمكن أن يحفز الخلايا السرطانية على الخضوع لعملية البقاء المعتمدة على الإجهاد”.
ويمكن أن تغير هذه الفكرة بشكل أساسي الطريقة التي يفكر بها الأطباء حول منع الانتكاس. وذكرت البروفيسور مونتيل أنه لا يوجد الكثير الذي يمكنك فعله ضد الخلايا المقاومة للأدوية، ولكن إذا كان الانتكاس بسبب آلية البقاء هذه، فإن هذه النتائج يمكن أن تساعد في إيجاد علاجات جديدة.
إن الأدوية التي تثبط ايه كي تي ١ (AKT1) قيد التجارب السريرية حاليًا. ويمكن دمج هذه العلاجات مع علاجات أخرى لزيادة فعاليتها، ما قد يُمكِّن الأطباء والباحثين من تثبيط أناستاسيس في الخلايا السرطانية مع تعزيز الخلايا الطبيعية. ويمكن للخلايا السرطانية الناجحة – علاوة على ذلك – أن تحفز موت الخلايا المبرمج في الخلايا التائية التي يرسلها الجهاز المناعي لمهاجمتها، وفقًا للبروفيسور مونتيل. ويقدم هذا هدفًا آخر لعلاجات أناستاسيس. وقالت البروفيسور مونتيل: “هناك حرب مستمرة بين الجهاز المناعي والسرطان، وإذا كان بإمكانك قلب الميزان ولو قليلاً، فإنه يمكنك البدء في الفوز”.
*تمت الترجمة بتصرف
لمزيد من المعلومات: Gongping Sun et al. Akt1 and dCIZ1 promote cell survival from apoptotic caspase activation during regeneration and oncogenic overgrowth, Nature Communications(2020). DOI: 10.1038/s41467-020-19068-2
المصدر:
https://phys.org/news/2020-11-insights-cellular-suicide-avenues-cancer.html
الهوامش::
[١] كاسبيسات (Caspases) هي عائلة من إنزيمات البروتياز التي تلعب أدوارًا أساسية في موت الخلايا المبرمج. وقد تم تسميتها باسم الكاسبيسات نظرًا لنشاط بروتياز السيستين الخاص بها – يهاجم السيستين في موقعه النشط، بشكل محب للأنوية، البروتين المستهدف ويشق البروتين المستهدف فقط بعد بقايا حمض الأسبارتيك. ويكيبيديا [٢] يشير اناستاسيس (Anastasis) إلى التعافي الخلوي من حافة الموت المبرمج. أناستاسيس هي عملية تنجو بها الخلايا من تنشيط كاسباس الجلاد بعد التعرض العابر لجرعة قاتلة من محفز موت الخلايا المبرمج. المصدر: https://bmcbiol.biomedcentral.com/articles/10.1186/s12915-017-0441-z علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية
