[قوة الجرعة الخفية: لماذا تنجح الأدوية مع شخص وتفشل مع آخر؟ الإجابة قد تكمن في أمعائك].
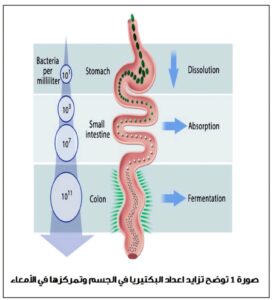
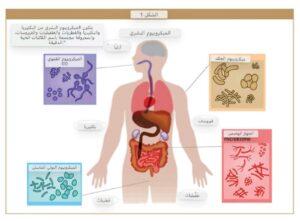
لم يعد جسد الإنسان يُفهم ككيان ذاتي منفصل، بل كنظام بيولوجي هائل يُشاركه فيه مجتمع خفي من الكائنات الدقيقة يُعرف بـ “الميكروبيوم المعوي”. يُشكل الميكروبيوم المعوي نظامًا بيئيًا معقدًا يضم تريليونات الكائنات الدقيقة، بما في ذلك البكتيريا، الأركيا، الفطريات، والفيروسات، بإجمالي حوالي (10)14 ميكروبًا، وهو يفوق عدد خلايا الجسم بنسبة 10:1.
يتميز بتنوع يصل إلى أكثر من 3000 نوع بكتيري، مع أقل من 130 جنسًا، ويتركز في الأمعاء. يساهم في الهضم، المناعة، والاستقلاب، مع جينوم يحتوي حتى 8 ملايين جين، مؤثرًا على الصحة العامة والوقاية من الأمراض. إن صحة هذا النظام وتوازنه (Eubiosis) هي أساس الصحة المثلى.
يشهد عالم الميكروبيوم، ثورة هادئة في فهمنا للصحة والمرض. ففي العشر سنين الأخيرة (2024-2014) ، تضاعف عدد الأبحاث المنشورة أكثر من خمس مرات، متجاوزاً 89 ألف دراسة. لم تعد هذه الأبحاث تقتصر على مجرد توصيف أنواع البكتيريا في أمعائنا، بل تعمقت في فهم دورها الوظيفي وتأثيرها المباشر على صحتنا.
امتدت مجالات البحث لتشمل علاقة الميكروبيوم بالأمراض الأيضية، والاضطرابات العصبية، وقوة جهاز المناعة. كما برزت اتجاهات بحثية واعدة تركز على الطب الدقيق والتغذية الشخصية، حيث يتم تصميم تدخلات غذائية وعلاجات تجريبية تستهدف تعديل الميكروبيوم لتحسين الصحة والوقاية من الأمراض، مما يفتح آفاقاً علاجية جديدة ومبتكرة.
مع شيوع وانتشار العلاجات الحديثة، خاصة في مجال الأورام، اتضح أن هذه المستعمرات الميكروبية تملك قوة غير متوقعة في تحديد مصير العلاج.
لقد أثبت علم الميكروبيوم الدوائي (Pharmacomicropbiomics) أن العلاقة بين الأدوية الشائعة والميكروبيوم هي علاقة ثنائية الاتجاه وعميقة للغاية: الأدوية تؤثر بعنف على الميكروبيوم، والأهم، أن الميكروبيوم يتحكم في فعالية الأدوية وسميتها.
هذه التفاعلات ليست مجرد ملاحظات هامشية، بل هي الأساس الذي يفسر التباين الهائل في الاستجابة للعلاج بين الأفراد، مما يدعو إلى إعادة تقييم جذرية لأساليبنا في الوصفات الطبية.
أولاً: الأثر التدميري: الأدوية كعامل هدم للنظام البيئي المعوي
يُعد “خلل التوازن الميكروبي” (Dysbiosis) النتيجة الأكثر شيوعاً للتفاعلات الدوائية، وهو اضطراب يؤدي إلى انخفاض التنوع البكتيري، وهيمنة السلالات غير المرغوبة، ما يرتبط بزيادة خطر الإصابة بأمراض المناعة الذاتية، والسمنة، واضطرابات الأيض:
1. المضادات الحيوية: الصدمة البيئية العظمى
تُعد المضادات الحيوية سلاحاً غير تمييزي يقضي على البكتيريا الضارة والنافعة على حد سواء، مما يُشكل “صدمة” للنظام البيئي المعوي.
آليات الضرر والتداعيات الجزيئية:
- التدمير الشامل وانخفاض الوقود الخلوي: تُفقد آلاف الأنواع البكتيرية في أيام من بدء العلاج. هذا التدمير يؤدي إلى انخفاض حاد في إنتاج الأحماض الدهنية قصيرة السلسلة (SCFA) التي تنتجها البكتيريا، وهي مركبات حيوية للتواصل بين الأمعاء والدماغ (Gut-Brain Axis). أحد هذه الأحماض هو البيوتيرات (butyrate) ، الذي تحافظ على سلامة الحاجز المعوي. انخفاضها يساهم في ظاهرة “الأمعاء المتسربة” وزيادة الالتهاب الجهازي.
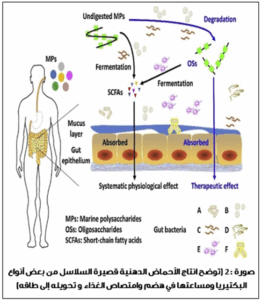
- التأثير طويل الأمد ومخزون الجينات: تشير الأبحاث الحديثة إلى أن الضرر لا يزول بسرعة. وجدت دراسة متابعة لسنوات، أن بعض التغييرات التي تحدثها المضادات الحيوية (مثل مجموعة الماكروليدات) على أنواع معينة من البكتيريا تكون دائمة أو شبه دائمة. الأهم من ذلك، أن استخدام المضادات الحيوية يزيد من تجميع “جينات المقاومة” في البكتيريا المتبقية، مما يُنشئ خزانًا للمقاومة الدوائية التي تنتقل إلى الممرضات، ويزيد من تفاقم أزمة المقاومة العالمية للمضادات الحيوية.
- خطر المطثية العسيرة: إن أبرز الآثار السلبية لخلل التوازن هو تمكين بكتيريا المطثية العسيرة (C. diff)، التي غالباً ما تكون مقاومة للمضادات، من النمو بشكل غير منضبط في بيئة خالية من المنافسين الطبيعيين، مما يسبب التهاب قولوني قد يكون قاتلاً.
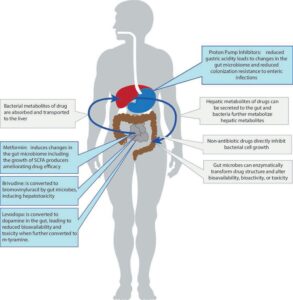
2. مثبطات مضخة البروتون (PPIs) وإفساد البيئة الكيميائية
تقلل هذه الأدوية حموضة المعدة، ما يزيل الحاجز الكيميائي الأول ضد الكائنات الدقيقة. هذا يسهل انتقال البكتيريا الفموية والبيئية إلى الأمعاء (Translocation)، ويؤدي إلى انخفاض التنوع البكتيري وزيادة خطر الإصابة بالتهاب القولون الناتج عن المطثية العسيرة (C. diff)، وزيادة نمو بكتيريا الأمعاء الدقيقة الزائد (SIBO).
3. الأدوية المؤثرة على الأيض والجهاز العصبي
الآثار السلبية تمتد لتشمل أدوية الجهاز العصبي (مثل مضادات الاكتئاب SSRIs) التي تثبط نمو سلالات بكتيرية معينة، ما يؤثر على إنتاج النواقل العصبية المعوية. كما أن أدوية السكري (الميتفورمين) تغير الميكروبيوم بشكل ملحوظ، مما يفسر الأعراض الهضمية الشائعة لدى المرضى.
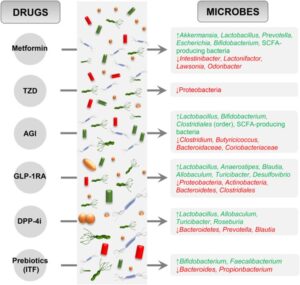
ثانياً: التأثير المزدوج: الميكروبيوم المتحكم في السمية ونتائج العلاج
إن الميكروبيوم هو “مفاعل كيميائي ثانٍ” يحدد مصير الدواء وشدة الأعراض الجانبية والنجاح العلاجي.
1. الميكروبيوتا والآثار الجانبية: تحديد التباين في السمية
يُعد الميكروبيوم محدداً قوياً لمدى سمية الدواء وتحمل المريض له، أكثر من الجينات البشرية في بعض الحالات:
• زيادة سمية الأدوية الكيماوية عبر “إعادة التفعيل”: أبرز مثال هو عقار إيرينوتيكان (Irinotecan) المضاد للسرطان. بعد أن يتم تثبيطه وإفرازه في الأمعاء بواسطة الكبد، تمتلك أنواع معينة من البكتيريا المعوية إنزيمات تسمى بيتا-جلوكورونيداز (Beta-glucuronidase).
تقوم هذه الإنزيمات بـ “إعادة تفعيل” الدواء إلى شكله السام، مما يؤدي إلى تضرر خلايا الأمعاء والإصابة بـ إسهال حاد ومهدد للحياة (التهاب القولون السمّي). اختلاف وفرة هذه البكتيريا بين المرضى هو العامل الرئيسي الذي يفسر تباينهم الحاد في شدة الأعراض الجانبية. المريض الذي لديه وفرة من هذه البكتيريا سيعاني من سمية أشد بكثير. هذا الاكتشاف أدى إلى تطوير مثبطات انتقائية لهذا الإنزيم البكتيري كعلاج مصاحب لتقليل السمية.
• التفاعلات الالتهابية والتحسسية: يمكن للميكروبيوتا أن تُعدل الدواء كيميائياً لإنتاج جزيئات جديدة تُنشط الجهاز المناعي كمستضدات (Antigens)، ما يؤدي إلى تفاعلات التهابية أو تحسسية غير متوقعة. هذه الظاهرة تزيد من “نفاذية الأمعاء”، ما يسمح للجزيئات السامة بالعبور إلى مجرى الدم، الأمر الذي يؤدي إلى أعراض جهازية ومضاعفات مناعية ذاتية.
• التأثير على فعالية الدواء: في المقابل، تحتاج بعض الأدوية الأولية (Prodrugs)، مثل السولفاسالازين (لعلاج التهاب القولون)، إلى إنزيمات بكتيرية معينة لتكسيره إلى شكله الفعال. غياب هذه البكتيريا يعني فشل العلاج وعدم الوصول إلى التركيز العلاجي المطلوب.
2. البكتيريا ومثبطات نقاط التفتيش المناعية (ICIs): مفتاح الاستجابة للسرطان
مثبطات نقاط التفتيش المناعية (Immune Checkpoint Inhibitors) (ICIs) هي علاجات ثورية للسرطان تهدف لإزالة “مكابح” الجهاز المناعي. لكن نجاحها يرتبط ارتباطاً وثيقاً بتركيبة الميكروبيوم المعوي.
3. الآليات الجزيئية لدعم الميكروبيوتا للعلاج المناعي:
• الكائنات الدقيقة المحورية (Akkermansia muciniphila): أثبتت الدراسات السريرية، أنها علامة حيوية قوية للتنبؤ بالاستجابة للعلاج المناعي (مثل Nivolumab و Pembrolizumab) في أنواع مثل سرطان الرئة والميلانوما. المرضى الذين لديهم وفرة من A. muciniphila يظهرون استجابة مناعية أقوى تجاه الأورام. تعمل هذه البكتيريا على تعزيز نفاذية الخلايا التائية القاتلة (CD8+ T cells) إلى البيئة الدقيقة للورم، وتعديل إشارات المناعة في الأمعاء التي تؤثر بدورها على الاستجابة الجهازية.
• المستقلبات كوسطاء مناعيين: سلالات معينة من البكتيريا (مثل Bifidobacterium و Bacteroides) تنتج مستقلبات (Metabolites) معينة، مثل الأحماض الدهنية قصيرة السلسلة (SCFA) ، التي لا تغذي فقط خلايا الأمعاء، بل تنتقل عبر الدم لتعديل النشاط المناعي في العقد اللمفاوية ومحيط الورم، مما يعزز قدرة الـ (ICIs) على تحرير الجهاز المناعي.
• التطبيق العلاجي (FMT): هذا الفهم أدى إلى تجارب سريرية لاستخدام زراعة الميكروبيوم البرازي (FMT). يتم نقل ميكروبيوم من مرضى استجابوا بامتياز لـ (ICIs) إلى مرضى لم يستجيبوا، مما أدى في بعض الحالات إلى تحويلهم إلى مستجيبين فعالين، مما يثبت العلاقة السببية بين الميكروبيوم ونجاح العلاج.
ثالثاً: التوجه المستقبلي: الطب المخصص والتوازن المستدام
إن هذه الاكتشافات تدفع باتجاه دمج تحليل الميكروبيوم في التقييم السريري الروتيني، للوصول إلى عصر الطب الميكروبيولوجي الشخصي.
• التنميط الميكروبي (Microbiome Profiling): في المستقبل القريب، يمكن أن يصبح تحليل الميكروبيوم اختباراً روتينياً، قبل البدء في العلاجات عالية المخاطر (مثل ICIs أو الكيماوي). يمكن لهذا “التنميط” أن يوجه الأطباء نحو اختيار الدواء والجرعة الأكثر فعالية، أو تحديد الحاجة إلى تدخلات ميكروبية مساعدة.
• البروبيوتيك العلاجي: تتجه الأبحاث نحو تطوير بروبيوتيك علاجي “من الجيل التالي” يحتوي على سلالات معروفة بقدرتها على تعزيز فعالية الأدوية أو تقليل سميتها.
• تصميم أدوية صديقة للميكروبيوم: يهدف البحث الصيدلي الآن إلى تصميم جزيئات دوائية لا تؤثر سلبًا على البكتيريا النافعة، أو حتى تستغل نشاطها لزيادة الفعالية العلاجية.
لقد أثبت العلم بما لا يدع مجالاً للشك أن الجرعات الدوائية التي نتناولها، ليست مجرد مواد كيميائية تستهدف العرَض المعين، بل هي قوة بيولوجية جارفة تُعيد تشكيل عالمنا الخفي. إن ما كشفته لنا ثورة الميكروبيوم يدعونا إلى وقفة تأمل عميقة، وإلى إعادة تعريف جذرية للعلاقة بين الإنسان والدواء.
لقد تعرفنا عن قدرة حبة مضاد حيوي بسيطة، على إحداث دماراً بيئياً يستمر لسنوات، وكيف أن تركيبتنا البكتيرية الفريدة، هي التي تحدد ما إذا كان دواء السرطان الأغلى والأكثر تطوراً سينجح أم سيفشل. إن الدواء يؤثر فينا بطريقة لم نتخيلها سابقاً؛ ليس فقط على أعضائنا الظاهرة، بل على مصير تريليونات الشركاء المجهريين الذين يمسكون بخيوط مناعتنا وأيضنا وسعادتنا.
إنها دعوة للحذر واليقظة:
• للطبيب الواصف: تذكر أن كل وصفة هي قرار ومسؤولية، تجاه نظام بيولوجي كامل. يجب أن يُعطى الدواء بحكمة وفطنة، وليس مجرد استجابة لطلب.
• للفرد المتلقي: تذكر أن حمايتك الحقيقية تبدأ من الداخل. إن اللجوء إلى الدواء يجب أن يكون الملاذ الأخير، بعد أن نكون قد استنفذنا قوة الغذاء ونمط الحياة في الحفاظ على هذا التوازن الميكروبي الثمين. .
في الختام، يجب أن نعي أن العافية المستدامة لا تتحقق بمجرد قمع الأعراض، بل بصيانة الشراكة البيولوجية. فلنتأمل ونحذر، لنضمن أن تكون أدويتنا عوامل شفاء، وليست محفزات لخلل بيولوجي لا يمكن تداركه.

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية