Stem cell therapies advance in Parkinson’s disease and beyond
(Natalie Healey – بقلم: ناتالي هيلي [كاتبة مستقلة، لندن، المملكة المتحدة])
تُمثل التجارب الرائدة التي تُستخدم فيها الخلايا الجذعية لعلاج مرض باركنسون في الولايات المتحدة الأمريكية واليابان نقطة تحول في مجال العلاج الخلوي في مجال التنكس العصبي. كما تُظهر أساليب مماثلة لعلاج مرض ألزهايمر والتصلب الجانبي الضموري بوادر واعدة.
خلال ذروة إغلاق مدينة نيويورك بسبب جائحة كوفيد-19، وصلت مجموعة صغيرة من الأشخاص المصابين بمرض باركنسون إلى مركز “ميموريال سلون كيترينج” للسرطان لإجراء عملية جراحية عصبية تجريبية: زرع خلايا عصبية منتجة للدوبامين مزروعة من خلايا جذعية جنينية بشرية. والآن، نشر الباحثون الذين هم وراء التجربة نتائج دراسة المرحلة الأولى، والتي أظهرت أن الخلايا المزروعة نجت وأطلقت الدوبامين وكانت جيدة التحمل1. حتى أن بعض المشاركين شهدوا انخفاضًا ملحوظًا في الرعشة.

وكانت النتائج مشجعة بما يكفي لإدارة الغذاء والدواء الأمريكية لمنح البرنامج وضعًا خاصًا كعلاج متقدم في الطب التجديدي وتصنيفًا سريعًا، مما مكّن الفريق من الانتقال مباشرة إلى تجربة المرحلة الثالثة. ويقول عالم الأحياء المتخصص في الخلايا الجذعية البروفيسور لورينز ستودر [عالم أحياء وعالم أعصاب سويسري، وهو مؤسس ومدير مركز بيولوجيا الخلايا الجذعية في مركز “ميموريال سلون كيترينج” للسرطان في مدينة نيويورك] في مركز “ميموريال سلون كيترينج” للسرطان، والذي شارك في قيادة المشروع إلى جانب زميلته فيفيان تابار [طبيبة جراحة أعصاب لبنانية الأصل]، لقد استغرق الأمر أكثر من 20 عامًا للوصول إلى هذه النقطة. وتبدو النتائج من حيث السلامة والفعالية واعدة للغاية. ولذا، لم نكن لنأمل في نتائج أفضل في هذه المرحلة.
وهذه التجربة، التي ترعاها شركة “بلو روك ثيرابيوتكس” (BlueRock Therapeutics)، وهي شركة تقنية حيوية مقرها كامبريدج، بولاية ماساتشوستس، حيث يُعد البروفيسور ستودر والدكتورة تابار من المؤسسين العلميين، تمثل [التجربة] نقطة تحول مهمة في السعي نحو العلاجات التجديدية للأمراض العصبية التنكسية – وهو مجالٌ لطالما أعاقته محدودية الأدوية التقليدية. ويوفر العلاج بالخلايا الجذعية إمكانية استبدال الخلايا العصبية الميتة أو حمايتها، ووقف تطور الأمراض العصبية المدمرة. ولكن الباحثين الذين يُجرون مثل هذه العلاجات في العيادات يواجهون العديد من التعقيدات.
التقدم في علاج مرض باركنسون
لا يُعد فريق البروفيسور ستودر والدكتورة تابار الفريق الوحيد الذي يُحقق نجاحًا في زراعة الخلايا الجذعية لعلاج مرض باركنسون. ففي اليابان، أكمل باحثون المرحلة الأولى والثانية من تجربة، نُشرت في مجلة “نيتشر” (Nature)2، باستخدام خلايا متبرع بالغ رُحِّلت إلى حالة متعددة القدرات (خلايا متعددة القدرات مُستحثة) ثم حُوِّلت إلى خلايا سلفية عصبية. وعلى مدار الدراسة التي استمرت عامين، لم يُلاحظ الفريق أي مشاكل كبيرة تتعلق بالسلامة لدى سبعة مرضى عولجوا في مستشفى جامعة كيوتو، ولاحظ بعض المشاركين تحسنًا في أعراض مرض باركنسون لديهم.
كما تُعِدّ فرق أخرى، بما في ذلك فريق بقيادة البروفيسور مالين بارمار في لوند، السويد، نتائج تجارب أولية لعلاج الخلايا الجذعية لمرض باركنسون. وتقول الدكتورة تابار إن تعاونًا دوليًا، يُنسَّق من خلال اتحاد “جي فورس – بي دي” (GForce-PD) [مبادرة عالمية جديدة حول العلاجات القائمة على الخلايا الجذعية لمرض باركنسون]، يُساعد على تقدم هذا المجال بشكل أسرع وأكثر أمانًا.
وتُوضِّح الدكتورة تابار أن مرض باركنسون، من بين أمراض الدماغ، يُعتبر على نطاق واسع “النموذج الأمثل” لعلاج الخلايا الجذعية. وذلك لأنه ينطوي على فقدان نوع واحد محدد جيدًا من الخلايا العصبية. وتضيف: “إذا تمكنا من إنجاح هذا، فإنه يفتح الباب أمام معالجة حالات أكثر تعقيدًا بكثير”. وستشمل تجربة المرحلة الثالثة القادمة للفريق 102 مشاركًا، مع نقطة نهاية أساسية تنظر الى تحسن أعراض الحركة لدى المرضى على مدار 78 أسبوعًا، وستشمل جراحات وهمية كعنصر تحكم.
ومع ذلك، حتى في مرض باركنسون، لا تزال هناك تحديات، كما يوضح البوفيسور كلايف سفيندسن، عالم الأعصاب في مركز “سيدارز-سيناي” الطبي في لوس أنجلوس، بولاية كاليفورنيا. وفي هذا المرض، توجد خلايا الدوبامين المفقودة في جذع الدماغ وتمتد على طول الطريق إلى الجسم المخطط. وبالتالي، فإن حقن علاجات الخلايا الجذعية في المخطط لا يعيد الحلقة العصبية بالكامل. يقول سفيندسن: “إذا لم تكن خلايا الدوبامين في الدائرة بشكل صحيح، أو كانت تطلق الكثير من الإشارات، فقد يكون لديك ما يسمى بخلل الحركة الجامح – وهي حركة غير طبيعية ناتجة عن عملية الزرع”. ومع ذلك، يقول البروفيسور ستودر إنه لم يكن هناك دليل على حدوث خلل في الحركة، أو أي آثار جانبية خطيرة أخرى، في تجربتهم في مركز “ميموريال سلون كيترينج” للسرطان.
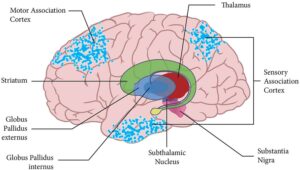
إعادة بناء الدماغ
على الرغم من أن مرض باركنسون يُهيمن حاليًا على الاهتمام، إلا أن العلاج بالخلايا الجذعية يُظهر نتائج واعدة في مجموعة من الحالات العصبية. فعلى سبيل المثال، يُجري البروفيسور سفيندسن اختبارًا لعلاج الخلايا الجذعية لدى الأشخاص المصابين بالتصلب الجانبي الضموري، وهو مرض مُتقدم يُدمر الخلايا العصبية الحركية ويُؤدي إلى الشلل.
ويستخدم فريقه الخلايا السلفية العصبية البشرية لتوليد الخلايا النجمية التي تُفرز عوامل نمو عصبية وقائية. وبدلًا من استبدال الخلايا العصبية، يُساعد البروفيسور سفيندسن الخلايا الناجية على البقاء على قيد الحياة لفترة أطول. وقد أظهرت تجربة مبكرة استهدفت الحبل الشوكي تباطؤًا طفيفًا في تطور المرض في الجانب المُعالج من الجسم3. كما تُجرى حاليًا تجربة من المرحلة 1/2أ، تستهدف هذه المرة القشرة الحركية. وتُحرز مجموعات بحثية أخرى، مثل مجموعة طبيبة الأعصاب البروفيسور ليتيزيا مازيني في جامعة شرق بييمونتي في إيطاليا، تقدمًا في استخدام الخلايا الجذعية في علاج التصلب الجانبي الضموري. ويُعِدّ فريقها تجربةً من المرحلة الثانية لزراعة الخلايا العصبية الجنينية، بناءً على بروتوكولاتٍ مُختَبَرة في التصلب اللويحي.
ولعلاج مرض الزهايمر، تُطوّر شركة “لونجفيرون”، وهي شركةٌ للتقنية الحيوية مقرّها ميامي، علاجًا بالخلايا الجذعية الوسيطة “لاروميستروسيل” (laromestrocel)، وهي خلايا مُشتقة من نخاع العظم قادرة على التمايز إلى أنواعٍ مُختلفة من الخلايا. وأظهرت نتائج تجربتها في المرحلة الثانية (2أ)، التي استمرت 39 أسبوعًا وشملت 49 مريضًا، انخفاضًا في ضمور الدماغ، ولا سيما في الحُصين والفص الصدغي، وعلاماتٍ على انخفاض الالتهاب بعد حقنةٍ واحدة. ويقول جوشوا هير، كبير المسؤولين العلميين في الشركة: “كان من المُفاجئ رؤية هذه البيانات المُقنعة مع صغر حجم العينات وقصر مدة التجربة نسبيًا”. وقد منحت إدارة الغذاء والدواء الأمريكية علاج “لاروميستروسيل” صفة العلاج المُتقدم في الطب التجديدي، مما يسمح للشركة بمُتابعة تجربة 2ب/3 المُبسّطة.
وفي مجالاتٍ أخرى، تتقدم تجارب الخلايا الجذعية في علاج الصرع، والتنكس البقعي، وإصابات النخاع الشوكي. فعلى سبيل المثال، أعلنت شركة “نيورونا ثيرابيوتكس”، وهي شركة تقنية حيوية في سان فرانسيسكو، كاليفورنيا، عن عزمها إجراء دراسة من المرحلة الثالثة لاختبار “إن آر تي اكس-100” (NRTX-100)، وهو علاج تجديدي مشتق من الخلايا الجذعية البشرية متعددة القدرات، ينقل الخلايا العصبية المفرزة لحمض غاما أمينوبوتيريك (GABA) إلى الدماغ لتقليل النوبات، وذلك لعلاج الصرع المقاوم للأدوية. وأظهرت نتائج المرحلة الأولى والثانية أن 80% من المشاركين أفادوا بانخفاض في النوبات بنسبة تزيد عن 75% بعد 7-12 شهرًا من تلقي جرعة منخفضة من “إن آر تي اكس-100”.
أي الخلايا هي الأفضل؟
يستكشف الباحثون إيجابيات وسلبيات استراتيجيات الخلايا الجذعية المختلفة. ويمكن للخلايا الجذعية الجنينية أن تتطور إلى جميع أنواع الخلايا، إلا أن هذا يثير مخاوف أخلاقية بشأن تدمير الأجنة. وتُقدّر الخلايا الجذعية المتوسطة، مثل تلك التي تستخدمها شركة “لونجفيرون”، لخصائصها المعدّلة للمناعة والمضادة للالتهابات. يقول هير إنه يمكن الحصول عليها من متبرع واحد واستخدامها لدى العديد من المرضى دون إثارة استجابة مناعية.
يقول الدكتور روجر حجار، مدير معهد ماساتشوستس العام للعلاج الجيني والخلايا في بوسطن، ماساتشوستس، إن ميزة الخلايا متعددة القدرات المستحثة تكمن في تنوعها الهائل. ويضيف: “مرونتها ميزة هائلة”. ولكنها تنطوي أيضًا على مخاطر أعلى لاستجابات مناعية غير متوقعة. ونتيجة لذلك، غالبًا ما تتطلب الخلايا متعددة القدرات المستحثة بروتوكولات تصنيع وسلامة أكثر تعقيدًا. ويضيف هير: “ولا يزال من غير الواضح حاليًا ما إذا كانت قادرة على الاندماج بشكل صحيح في دوائر الدماغ، أو معالجة مكونات الخلل الالتهابي والوعائي المصاحب للأمراض العصبية التنكسية”.
لعبة الانتظار
يُعدّ الوقت تحديًا رئيسيًا آخر في زراعة الخلايا الجذعية العصبية. وقد تستغرق الخلايا الجذعية المزروعة سنوات حتى تنضج وتتكامل. ومع ذلك، تُصمّم العديد من التجارب السريرية بفترات متابعة تصل إلى عامين، وهي فترات قد تكون قصيرة جدًا لالتقاط التأثير الكامل. ثم هناك مشكلة الاستمرارية. ويقول البروفيسور سفيندسن إنه في حال ظهور آثار جانبية على حبة دواء، يُمكن التوقف عن تناولها.
ولكن بمجرد زرع الخلايا الجذعية، تبقى مدى الحياة. وتُثير الطبيعة غير القابلة للعكس لزراعة الخلايا الجذعية تساؤلات أخلاقية حول الموافقة المستنيرة والمراقبة بعد التجربة. ويُحذّر من أنه في حال توقف الشركة الراعية عن العمل، أو إذا أوقفت الحكومة تمويل مشروع بحثي، فسيظل المشاركون في التجربة يحملون الطعوم الحية، وقد لا تتم متابعتهم بشكل مناسب.
وتُعدّ التكلفة وسهولة الوصول أيضًا من المسائل الرئيسية المطروحة. وعلاجات الخلايا الجذعية ليست رخيصة. ولكن إذا كانت تُقدّم فوائد طويلة الأمد من جرعة واحدة أو عدد محدود من الجرعات، فقد تُثبت في النهاية فعاليتها من حيث التكلفة، كما يقول راش. ويضيف أن توسيع نطاق الإنتاج يُمثل تحديًا آخر. فالأمر لا يقتصر على العلم فحسب، بل يتعلق أيضًا بالأنظمة التي ستُقدم علاجات الخلايا الجذعية العصبية.
وعلى الرغم من التعقيدات، لا يزال الباحثون متفائلين بحذر. ويقول البروفيسور سفيندسن إن التطورات في مجال تحرير الجينات، مثل الخلايا المُستحثة متعددة القدرات المُعدلة بتقنية “كريسبر” (CRISPR)، والتي تتميز بمرونة أكبر أو أقل عرضة لإثارة الرفض من قِبل الجهاز المناعي، قيد الدراسة بالفعل. وتشير الدكتور مازيني إلى أن التطورات في تصنيع الخلايا الآلي تُسهّل توسيع نطاق الإنتاج.
وفي غضون ذلك، بدأ الذكاء الاصطناعي يلعب دورًا في جميع مراحل التطوير، بدءًا من تحسين إنتاج الخلايا ووصولًا إلى تحليل بيانات التجارب السريرية، كما تضيف. وإلى جانب زيادة مشاركة الصناعة، والقبول الأوسع لعلاج الخلايا الجذعية للحالات العصبية، من المتوقع أن تُسرّع هذه التطورات وتيرة التقدم في السنوات القادمة.
ما بدأ قبل عقود كفكرة طموحة يقترب الآن من الواقع السريري. وعلى الرغم من أن الطريق لا يزال طويلًا، إلا أن التجارب السريرية الحديثة تُشير إلى أنه من الممكن إصلاح الدماغ، العضو الأكثر تعقيدًا على الإطلاق. وتقول الدكتورة تابار: “أعتقد أن هذا سيفتح آفاقًا جديدة لعالمٍ جديد، حيث سنشهد المزيد من العلوم المثيرة”.
الجدول 1 | تجارب مختارة جارية على الخلايا الجذعية للأمراض العصبية التنكسية
| الحالة | نوع الخلية | الراعية والمؤسسة | مرحلة التجربة |
| مرض باركنسون | خلايا دوبامين عصبية مشتقة من الخلايا الجذعية الجنينية البشرية | شركة بلو روك ثيرابيوتكس وميموريال سلون كيترينج | المرحلة الأولى (مكتملة)1، المرحلة الثالثة (مخطط لها) |
| مرض باركنسون | خلايا دوبامين عصبية محفزة مشتقة من الخلايا الجذعية متعددة القدرات | شركة سوميتومو فارما وجامعة كيوتو | المرحلة الأولى/الثانية (مكتملة)2 |
| مرض باركنسون | خلايا دوبامين عصبية محفزة مشتقة من الخلايا الجذعية متعددة القدرات | جامعة لوند، جامعة كامبريدج، ومنطقة سكين | المرحلة الأولى/الثانية (قيد التنفيذ) |
| التصلب الجانبي الضموري | خلايا نجمية محفزة مشتقة من الخلايا الجذعية متعددة القدرات تفرز عامل التغذية العصبي المشتق من الخلايا الجذعية المشتقة من الخلايا الجذعية متعددة القدرات | مركز سيدارز- سيناء الطبي | المرحلة الأولى/الثانية (قيد التنفيذ) |
| التصلب الجانبي الضموري | الخلايا الجذعية العصبية الجنينية | جامعة شرق بيدمونت | المرحلة الثانية (مخطط لها) |
| مرض الزهايمر | الخلايا الجذعية المتوسطة (لاروميستروسيل) | لونغيفيرون | المرحلة 2أ (مكتملة)، المرحلة 2ب/3 (مخطط لها) |
| الصرع | الخلايا العصبية غابا المشتقة من الخلايا الجذعية البشرية متعددة القدرات “إن آر تي اكس-100” (NRTX-1001) | نيورونا ثيرابيوتكس | المرحلة 1/2 (جارية)، المرحلة 3 (مخطط لها) |
*تمت الترجمة بتصرف
المصدر:
https://www.nature.com/articles/d41591-025-00036-6
مراجع:
1. Tabar, V. et al. Nature 641, 978–983 (2025).
2. Sawamoto, N. et al. Nature 641, 971–977 (2025).
3. Baloh, R. H. et al. Nat. Med. 28, 1813–1822 (2022).
Rash, B. G. et al. Nat. Med. 31, 1257–1266 (2025).4

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية