تعتبر عملية تطوير الأدوية، رحلة طويلة ومكلفة ومحفوفة بالمخاطر، قد تمتد لعقد من الزمن وتكلف ما يقارب مليار الدولارات لكل دواء جديد يطرح في السوق. لهذا وفي ظل الحاجة الملحة لعلاجات جديدة للأمراض المستعصية والناشئة، برز مفهوم إعادة توجيه الأدوية (Drug Repurposing) – المعروف أيضًا باسم إعادة تموضع الأدوية أو إعادة استخدام الأدوية – كاستراتيجية واعدة وفعالة لتسريع اكتشاف العلاجات.
ما هو إعادة توجيه الأدوية؟
إعادة توجيه الأدوية تعني إيجاد استخدامات علاجية جديدة لمركبات دوائية كانت قد طُورت أو اعتُمدت مسبقًا لأغراض أخرى. هذه المركبات قد تكون أدوية موجودة في السوق بالفعل، وقد أكملت بنجاح مراحل التجارب السريرية وحصلت على موافقة الجهات التنظيمية لعلاج مؤشرات محددة. أو قد تكون أدوية فشلت في التجارب السريرية لمؤشرها الأصلي بسبب عدم الفعالية الكافية أو آثار جانبية غير مقبولة في ذلك السياق، لكنها أظهرت ملف سلامة مقبولاً بشكل عام.
يمكن أن تشمل أيضًا مركبات لم تتجاوز مراحل مبكرة من البحث والتطوير، أو حتى مركبات تم التخلي عنها لعدم وجود اهتمام تجاري كافٍ بها في وقتها. جوهر هذه الاستراتيجية يكمن في الاستفادة من المعرفة المتراكمة حول هذه المركبات، بما في ذلك بيانات سلامتها، حركيتها الدوائية (pharmacokinetics) (ما يفعله الجسم بالدواء ويمتصه ويوزعه ويستقلبه ويخرجه)، وديناميكيتها الدوائية (pharmacodynamics) (ما يفعله الدواء بالجسم وآلياته الجزيئية والخلوية).
لماذا يُعد إعادة توجيه الأدوية استراتيجية جذابة؟
تُقدم إعادة توجيه الأدوية عددًا من المزايا الجوهرية التي تجعلها بديلًا جذابًا ومكملًا لمسار تطوير الأدوية التقليدي:
1- تقليل المخاطر: تعد هذه الميزة هي الأكثر أهمية. بما أن الأدوية المعاد توجيهها قد خضعت بالفعل لتجارب السلامة المكثفة في البشر (المرحلة الأولى والمراحل المبكرة من الثانية)، فإن ملف سلامتها وسميتها معروف إلى حد كبير. هذا يقلل بشكل كبير من المخاطر المرتبطة بالتفاعلات الضارة المحتملة التي تظهر عادةً في المراحل المتأخرة من تطوير الدواء الجديد، حيث تكون معدلات الفشل مرتفعة جدًا بسبب قضايا السلامة. هذا يعني أن الدواء يمكن أن ينتقل مباشرة إلى تجارب الفعالية السريرية (المرحلة الثانية والثالثة) للمؤشر الجديد، مما يقلل من الغموض ويحسن من احتمالات النجاح.
2- تسريع الجدول الزمني: تطوير دواء جديد من الصفر يستغرق عادةً 10-15 عامًا. في المقابل، يمكن للأدوية المعاد توجيهها أن تتجاوز المراحل المبكرة من التجارب السريرية التي تركز بشكل أساسي على السلامة والجرعات. هذا يقلل بشكل جذري من الوقت اللازم لطرح الدواء في السوق، مما يعني وصول العلاجات الجديدة إلى المرضى بشكل أسرع بكثير. على سبيل المثال، في حالات الطوارئ الصحية العامة مثل الأوبئة، يمكن أن توفر هذه السرعة فرقًا هائلاً في الاستجابة.
3- خفض التكاليف: تطوير دواء جديد يكلف في المتوسط مليارات الدولارات. إعادة توجيه الأدوية تقلل بشكل كبير من هذه التكاليف، حيث يمكن الاستفادة من البيانات الموجودة (خاصة بيانات ما قبل السريرية والسريرية المبكرة) ولا يتطلب الأمر استثمارات كبيرة في البحث والتطوير الأولي (discovery phase). هذا يجعلها خيارًا جذابًا للشركات الصغيرة، المؤسسات الأكاديمية، ولتطوير علاجات للأمراض التي لا تحظى باهتمام تجاري كبير.
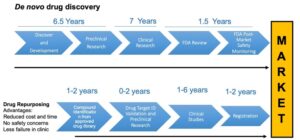
4- معدل نجاح أعلى: نظرًا لأن هذه الأدوية قد أظهرت بالفعل فعالية في بيئة بيولوجية (حتى لو كانت لمؤشر مختلف)، فإن فرص نجاحها في التطبيقات الجديدة غالبًا ما تكون أعلى بكثير مقارنة بالمركبات الجديدة تمامًا التي تبدأ من الصفر (حيث يتجاوز معدل الفشل 90%). الخبرة السابقة في استقلاب الدواء وتوافره الحيوي في جسم الإنسان تمنح ميزة كبيرة.
5- الوصول إلى “الأدوية اليتيمة” والأمراض المهملة: يمكن أن تكون إعادة توجيه الأدوية ذات أهمية خاصة لتطوير علاجات للأمراض النادرة (الأمراض اليتيمة) والأمراض المهملة، حيث يكون حافز الاستثمار في الأدوية الجديدة منخفضًا بسبب قلة عدد المرضى أو ضعف القدرة الشرائية. توفر هذه الاستراتيجية مسارًا أكثر جدوى اقتصاديًا لتطوير علاجات لهذه المجموعات السكانية المحتاجة.
آليات إعادة توجيه الأدوية
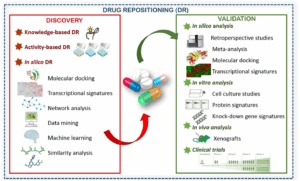
يمكن أن تتم عملية إعادة توجيه الأدوية من خلال عدة طرق، تتراوح بين الملاحظة السريرية العرضية إلى التحليلات الحسابية المتطورة والبيانات الضخمة:
1- الملاحظة السريرية (Clinical Observation): هي الطريقة الأقدم والأكثر “حظًا” في اكتشاف إعادة التوجيه. في بعض الأحيان، يلاحظ الأطباء أن دواءً معينًا يُظهر تأثيرًا غير متوقع على مرض آخر لدى المرضى الذين يتناولونه. على سبيل المثال، تم اكتشاف استخدام المينوكسيديل (Minoxidil) لعلاج الصلع (الثعلبة الأندروجينية) بعد ملاحظة نمو الشعر لدى المرضى الذين يتناولونه لعلاج ارتفاع ضغط الدم. هذا الاكتشاف العرضي أدى إلى تطوير تركيبات موضعية للمينوكسيديل كعلاج لفقدان الشعر الوراثي، وهو الآن أحد أكثر العلاجات شيوعًا.
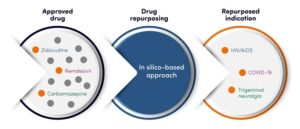
2- الأساليب التجريبية المستندة إلى الفحص (Experimental Screening Approaches): تتضمن هذه الطريقة فحص مكتبات كبيرة من المركبات الدوائية المعروفة ضد نماذج مرضية جديدة في المختبر (مثل الخلايا السرطانية، أو العوامل المسببة للأمراض مثل البكتيريا والفيروسات، أو نماذج حيوانية للمرض) لتحديد المركبات ذات النشاط البيولوجي المحتمل. يمكن أن يكون هذا الفحص عالي الإنتاجية (High-Throughput Screening – HTS)، مما يسمح بفحص آلاف المركبات بسرعة وكفاءة. على سبيل المثال، في جهود مكافحة كوفيد-19 (COVID-19)، تم فحص آلاف الأدوية الموجودة بسرعة في المختبرات لتحديد الأدوية التي يمكن أن تمنع تكاثر الفيروس، مما أدى إلى تحديد أدوية مثل الريمديسيفير (Remdesivir) كعلاج محتمل.
3- الأساليب الحسابية/المعلوماتية الحيوية (Computational/Bioinformatics Approaches): تُعد هذه الأساليب متطورة بشكل متزايد وتعتمد على قوة الحوسبة والبيانات الضخمة. تتضمن استخدام قواعد البيانات الضخمة (مثل بيانات التعبير الجيني، التفاعلات البروتينية-البروتينية، الخصائص الكيميائية-الفيزيائية للجزيئات الدوائية، والمسارات البيولوجية) لتحديد الأدوية التي قد يكون لها تأثير على مسارات مرضية معينة. يمكن أن تشمل هذه الأساليب:
1- تحليل التوقيع الجيني (Gene Signature Analysis): يعتمد على فكرة أن كل دواء ومرض له “توقيع” فريد من التعبير الجيني. تبحث هذه الطريقة عن الأدوية التي تعكس أو تحاكي التغييرات الجينية المرتبطة بمرض معين. فمثلاً، إذا كان مرض معين يتميز بفرط نشاط جينات معينة وقمع جينات أخرى، فالباحثون يبحثون عن الأدوية التي تنتج تأثيرًا معاكسًا على هذه الجينات، مما يشير إلى قدرتها على “تصحيح” المسار المرضي.
2- الربط الجزيئي (Molecular Docking): يتنبأ بكيفية ارتباط الدواء بأهداف بروتينية جديدة (مثل الإنزيمات أو المستقبلات) مرتبطة بمرض مختلف عن المؤشر الأصلي للدواء. تُستخدم هذه التقنية في تصميم الأدوية للمساعدة في تحديد المرشحين المحتملين لإعادة التوجيه من خلال تقييم مدى ملاءمة الدواء للارتباط ببروتين مستهدف في مرض مختلف.
3- تحليل الشبكات (Network Analysis): يحدد الأدوية التي تؤثر على شبكات بيولوجية معقدة مرتبطة بالمرض. من خلال تحليل شبكات التفاعل بين البروتينات والجينات والمسارات الخلوية المرتبطة بمرض معين، يمكن للباحثين تحديد الأدوية التي قد “تعيد ضبط” الشبكة المرضية إلى حالة صحية طبيعية أو تؤثر على نقاط محورية في شبكة المرض.
4- التعلم الآلي والذكاء الاصطناعي (Machine Learning and AI): استخدام خوارزميات متقدمة لتحليل مجموعات بيانات ضخمة ومعقدة (Big Data) لاكتشاف أنماط وعلاقات غير ظاهرة قد تشير إلى إمكانية إعادة توجيه دواء معين. دراسة حديثة استخدمت التعلم العميق لتحديد أدوية موجودة يمكن أن تكون فعالة ضد التليف الكيسي (Cystic Fibrosis) من خلال تحليل مجموعات بيانات التعبير الجيني للمرضى. يمكن للذكاء الاصطناعي تسريع عملية الفحص والتحقق بشكل غير مسبوق.
أمثلة ناجحة ودراسات علمية مفصلة لإعادة توجيه الأدوية
هناك العديد من الأمثلة البارزة على النجاحات في مجال إعادة توجيه الأدوية، والتي تدعمها دراسات علمية قوية:
1- الأسبرين (Aspirin): تم اكتشافه في الأصل كمسكن للألم ومضاد للالتهابات ومخفض للحرارة في نهاية القرن التاسع عشر. بعد عقود، أظهرت الدراسات السريرية الواسعة النطاق في الثمانينيات (مثل دراسة Physicians’ Health Study) أن الجرعات المنخفضة من الأسبرين (75-325 ملجم يوميًا) يمكن أن تقلل بشكل كبير من خطر النوبات القلبية والسكتات الدماغية عن طريق تثبيط تجمع الصفائح الدموية. هذا أدى إلى إعادة توجيهه على نطاق واسع كعامل مضاد لتخثر الدم للوقاية الثانوية والأولية لأمراض القلب والأوعية الدموية.
2- السيلدينافيل (Sildenafil): تم تطويره في البداية بواسطة فايزر لعلاج الذبحة الصدرية (ألم الصدر الناتج عن نقص تدفق الدم إلى القلب) في أوائل التسعينيات. أثناء التجارب السريرية للمرحلة الثانية، أبلغ المشاركون الذكور عن تأثير جانبي غير متوقع تمثل في تحسين ضعف الانتصاب. بناءً على هذه الملاحظة، أعادت فايزر توجيه الدواء وأجرت تجارب سريرية إضافية أدت إلى موافقة إدارة الغذاء والدواء (FDA) عليه كعلاج لضعف الانتصاب في عام 1998 تحت الاسم التجاري “فياغرا”. لاحقًا، تمت الموافقة على السيلدينافيل أيضًا لعلاج ارتفاع ضغط الدم الشرياني الرئوي (Pulmonary Arterial Hypertension – PAH)، وهو مثال آخر لإعادة التوجيه.
3- الميتفورمين (Metformin): دواء شائع لعلاج السكري من النوع الثاني لأكثر من 60 عامًا. الأبحاث الحديثة والدراسات الوبائية (مثل دراسة UKPDS – UK Prospective Diabetes Study) أظهرت أن المرضى الذين يتناولون الميتفورمين لمرض السكري يميلون إلى أن يكون لديهم معدلات إصابة أقل ببعض أنواع السرطان، مثل سرطان القولون والثدي والبروستاتا، وتحسين في نتائج العلاج. أدت هذه الملاحظات إلى عدد من التجارب السريرية الجارية مثل [Metformin in Lung Cancer (NCT01807358) و Metformin in Breast Cancer (NCT01807345)] التي تستكشف إمكانية استخدامه كعلاج مساعد للسرطان أو كعامل وقائي. كما تشير دراسات أخرى (مثل دراسة TAME – Targeting Aging with Metformin) إلى أن الميتفورمين قد يكون له تأثيرات مضادة للشيخوخة وإطالة العمر من خلال تأثيره على مسارات الأيض الخلوي مثل (mTOR) و (AMPK)، مما يوسع نطاق إعادة توجيهه بشكل كبير.
4- الثاليدوميد (Thalidomide): اكتسب سمعة سيئة في الستينيات بسبب آثاره التيراتجينية (المسببة لتشوهات خلقية شديدة مثل الفوكوميا) عند استخدامه كمهدئ ومضاد للغثيان لدى النساء الحوامل. ومع ذلك، في الثمانينيات والتسعينيات، أعيد اكتشافه كعلاج فعال لبعض أنواع السرطان (خاصة المايلوما المتعددة) والأمراض الالتهابية مثل الجذام بسبب خصائصه المعدلة للمناعة ومضادات تكوّن الأوعية الدموية. هذا الاكتشاف أدى إلى وضع بروتوكولات استخدام صارمة للغاية لضمان سلامة المرضى، مما يبرز أهمية إدارة المخاطر في إعادة التوجيه.
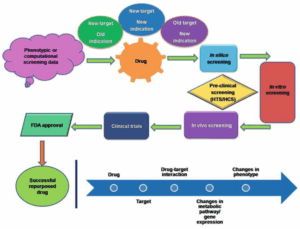
التحديات والآفاق المستقبلية لإعادة توجيه الأدوية
على الرغم من إمكانيات إعادة توجيه الأدوية الواعدة، إلا أنها لا تخلو من التحديات الجوهرية التي يجب معالجتها لتحقيق أقصى استفادة من هذه الاستراتيجية:
1- تحديد الجرعة والمؤشرات الجديدة: قد لا تكون الجرعة المثلى أو نظام العلاج لدواء مُعاد توجيهه هو نفسه في التطبيق الجديد. على سبيل المثال، الجرعة المضادة للالتهاب من الأسبرين تختلف تمامًا عن الجرعة المضادة للصفائح الدموية. هذا يتطلب تجارب سريرية إضافية مصممة خصيصًا لتحديد الجرعة والتركيبة المثلى للمؤشر الجديد، والتي يمكن أن تكون عملية معقدة.
2- الملكية الفكرية وبراءات الاختراع: بمجرد انتهاء صلاحية براءة اختراع الدواء الأصلي، قد يكون هناك حافز تجاري أقل للشركات الدوائية الكبيرة للاستثمار في إعادة توجيهه، نظرًا لعدم وجود حماية حصرية للمنتج. ومع ذلك، يمكن الحصول على براءات اختراع جديدة للمؤشرات العلاجية الجديدة (patent for new use) أو لتركيبات الجرعات الجديدة أو طرق الإعطاء المبتكرة. هذا المجال يمثل تحديًا قانونيًا وتجاريًا يتطلب استراتيجيات مبتكرة.
3- التحقق من الفعالية والسلامة: يجب أن تخضع الأدوية المعاد توجيهها لتجارب سريرية صارمة لإثبات فعاليتها وسلامتها في المؤشر الجديد، تمامًا مثل أي دواء جديد، لضمان أنها تلبي المعايير التنظيمية الصارمة [مثل تلك التي تحددها (FDA) أو (EMA)]. على الرغم من أن المرحلة الأولى تكون غالبًا مختصرة، إلا أن المراحل الثانية والثالثة من التجارب السريرية لا تزال ضرورية ومكلفة.
4- الفشل في التجارب السريرية: على الرغم من أن معدل النجاح أعلى، إلا أن الأدوية المعاد توجيهها لا تزال تواجه خطر الفشل في التجارب السريرية إذا لم تكن فعالة أو آمنة بما فيه الكفاية للمؤشر الجديد، أو إذا كانت الآثار الجانبية تفوق الفوائد في السياق الجديد.
5- التعقيد البيولوجي: العديد من الأمراض معقدة وتتأثر بمسارات بيولوجية متعددة. قد لا يكون للدواء المعاد توجيهه تأثير كافٍ على جميع المسارات الضرورية لتحقيق الفعالية العلاجية الكاملة.
في الختام، يُعد مبدأ إعادة توجيه الأدوية ركيزة أساسية وواعدة في مشهد اكتشاف وتطوير الأدوية المعاصر. من خلال الاستفادة من المعرفة والبيانات الموجودة حول المركبات الدوائية القائمة، يمكن لهذه الاستراتيجية أن تقلل بشكل كبير من الوقت والتكاليف والمخاطر المرتبطة بجلب علاجات جديدة إلى المرضى. مع التقدم المستمر في المعلوماتية الحيوية والتعلم الآلي، من المرجح أن تزداد كفاءة ودقة عملية إعادة توجيه الأدوية، مما يفتح آفاقًا جديدة لمعالجة الأمراض المستعصية طبيًا ويقدم بصيص أمل لملايين المرضى حول العالم.

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية
جميل بل رائع كل ما تقدمه دكتورنا الحبيب وشكرا لاثرائك ثقافتنا الدوائيه بهذا الكم الكبير والدقيق من المعلومات التي لا تصدر الا عن خبير قدير وفقك الله وسد خطاك👍👍🌹🌹🌹