تعرف الشيخوخة على أنها التغيرات الطبيعية المستمرة والتدريجية التي تطرأ على الجسد اعتبارًا من بدايات البلوغ حيث تبدأ العديد من وظائف الجسم بالتراجع في بدايات منتصف العمر وهي حقيقة بيولوجية لها طريقتها المعينة في الحدوث خارج نطاق التحكم البشري فلا يوجد سن محدد يمكن اعتباره سن الدخول في مرحلة الشيخوخة ولكن، جرى التعارف على أن عمر 65 سنة هو العمر الذي يشير إلى بداية سن الشيخوخة.

هذا العُرف لم يستند إلى أسس بيولوجية، وإنما هو عرف تاريخي جرى اختياره منذ سنين طويلة، فعمر 65 سنة اعتبر “سن للتقاعد” في ألمانيا، وهي أول دولة تضع برنامجًا للتقاعد، وقد جرى اعتماد نفس العمر في معظم الدول المتقدمة، على أن هذا العُرف قد تبدل لاحقًا فقد يصل البعض إلى عمر السبعين وهم يتمتعون بصحة جيدة، بينما البعض يحتاجون إلى رعاية الآخرين.
وتحدث الشيخوخة على مستوى التغيرات الجسدية كنتيجة لتراكم كميات كبيرة من نواتج تفاعلات الجزيئات والخلايا بمرور الوقت؛ مما يؤدي إلى تضاؤل تدريجي في القدرات الجسدية والنفسية، وزيادة احتمالية الإصابة بالأمراض، والموت في النهاية، ولكن هذه التغييرات ليست حتمية، فقد يصل بعض الأشخاص إلى عمر السبعين وما بعد سن السبعين بدونها، بينما البعض يصيبهم الوهن ويحتاجون إلى الرعاية المستمرة.
توجد عدة عوامل تؤثر على صحة كبار السن، قد تكون فردية (ذاتية) أو بيئية حيث تتنوع المشاكل الشائعة التي تصيب المسنين ما بين الجسدية والاجتماعية والنفسية حيث تكمن أهمية الشيخوخة الصحية في استمرار الاستقلالية عند أداء الاحتياجات اليومية.
؛؛اكتشف العلماء تغيرًا “كارثيًا” في تكوين خلايا الدم، مما يزيد من احتمالية ظهور علاجات جديدة لإبطاء عملية الشيخوخة؛؛
أثارت النظرية الرائدة للشيخوخة التي تفسر سبب ضعف الناس فجأة بعد بلوغ السبعينيات من العمر احتمالية ظهور علاجات جديدة للتدهور وأمراض الشيخوخة.
اكتشف باحثون في كامبريدج عملية تؤدي إلى تغيير “كارثي” في تكوين الدم لدى كبار السن، مما يزيد من خطر الإصابة بسرطان الدم وفقر الدم، ويضعف فعالية خلايا الدم البيضاء في مكافحة العدوى.
يعتقد العلماء أن تغيرات مماثلة تحدث في الأعضاء في جميع أنحاء الجسم، من الجلد إلى الدماغ، مما يحتمل أن يكون السبب وراء تقدم الناس في العمر بشكل صحي لعقود قبل أن يتعرضوا لانخفاض سريع في السبعينيات والثمانينيات من العمر.
قال الدكتور بيتر كامبل، كبير مؤلفي الدراسة ورئيس برنامج السرطان والشيخوخة والطفرات الجسدية في معهد سانجر في كامبريدج: “المثير في هذا العمل هو أنه قد تكون هناك مجموعة مشتركة من العمليات في العمل”. “في النهاية سيكون الهدف هو إبطاء عملية الشيخوخة أو التدخل فيها، ولكن على الأقل نرى خيارًا لاستخدام هذا لقياس العمر البيولوجي”.
؛؛الشيخوخة عملية معقدة، لكن العديد من العلماء يشتبهون في أن التراكم التدريجي للطفرات في الخلايا يؤدي تدريجيًا إلى تدهور قدرة الجسم على العمل بشكل صحيح؛؛
تشير أحدث الأبحاث إلى أن التفكير خاطئ، أو في أفضل الأحوال غير مكتمل، وتلقي اللوم بدلاً من ذلك على الخلايا “الأنانية” التي ترتفع إلى مستوى الهيمنة في سن الشيخوخة.
من خلال العمل مع العلماء في معهد ويلكوم-إم آر سي كامبريدج للخلايا الجذعية، درس كامبل وزملاؤه خلايا الدم عبر الفئة العمرية من الأطفال حديثي الولادة إلى الأشخاص في السبعينيات والثمانينيات من العمر فوجدوا أن البالغين الذين تقل أعمارهم عن 65 عامًا لديهم مجموعة واسعة من خلايا الدم الحمراء والبيضاء ينتجها مجموعة متنوعة من 20.000 إلى 200000 نوع مختلف من الخلايا الجذعية في نخاع العظام.
في الذين تزيد أعمارهم عن 65 عامًا، كانت الصورة مختلفة تمامًا. جاء حوالي نصف خلايا الدم لديهم من 10 أو 20 خلية جذعية متميزة، مما أدى إلى تقليل تنوع خلايا الدم لدى الشخص بشكل كبير، مع ما يترتب على ذلك من عواقب على صحتهم.
كتب الباحثون في دورية نيتشر، أوضحوا أنه في حين أن الخلايا الجذعية المتورطة في جعل الدم يجمع الطفرات بمرور الوقت، فإن معظم هذه التغييرات غير ضارة. ولكن تظهر المشكلات عندما تجعل الطفرات “الدافعة” النادرة الخلايا الجذعية تنمو بشكل أسرع، وغالبًا ما تنتج خلايا دم منخفضة الجودة كمقايضة.
عندما يكون الشخص في الثلاثينيات والأربعينيات من العمر، فإن ميزة نمو الخلايا الجذعية الشاذة تحدث فرقًا بسيطًا، ولكن في سن السبعين وأكثر، تهيمن هذه الخلايا سريعة النمو على إنتاج خلايا الدم.
قال كامبل: “النمو الهائل يفسر سبب حدوث مثل هذا التغيير المفاجئ في الضعف بعد سن السبعين، ولماذا يصيب الشيخوخة هذا النوع من العمر”. ترتبط خلايا الدم الجذعية سريعة النمو بسرطانات الدم وفقر الدم، ولكنها أيضًا تجعل الأشخاص أقل قدرة على تحمل العدوى والعلاجات الطبية مثل العلاج الكيميائي.
وأضاف كامبل: “ما نعرفه عن أنظمة الأعضاء الأخرى هو أن العديد من الملاحظات نفسها تنطبق” ، حيث يعتزم الباحثون الآن البحث عن نفس العملية في الجلد لفهم سبب تسبب الشيخوخة في ظهور التجاعيد وإبطاء التئام الجروح.
قالت الدكتورة إليسا لورينتي، الأستاذة المساعدة في معهد ويلكوم- إم آر سي كامبريدج للخلايا الجذعية والباحثة الرئيسية المشتركة في الدراسة، إن الالتهابات المزمنة والتدخين والعدوى والعلاج الكيميائي يمكن أن تنتج جميعها خلايا جذعية ذات طفرات مسببة للسرطان.
وقالت: “نتوقع أن تؤدي هذه العوامل أيضًا إلى انخفاض تنوع خلايا الدم الجذعية المرتبط بالشيخوخة”. من الممكن أن تكون هناك عوامل قد تؤدي إلى إبطاء هذه العملية أيضًا. لدينا الآن مهمة مثيرة تتمثل في اكتشاف كيفية تأثير هذه الطفرات المكتشفة حديثًا على وظائف الدم لدى كبار السن، حتى نتمكن من تعلم كيفية تقليل مخاطر الأمراض وتعزيز الشيخوخة الصحية”.
ولإبطاء العوامل التي تؤذي الى انخفاض تنوع خلايا الدم الجذعية المرتبط بالشيخوخة قام الكثير من العلماء حول العالم يالمقابل بابحاث وتجارب باستخدام تقنية الكرسبر (CRISPR) حيث ان هذه الأداة تعد أداة قوية لتحرير الجينوم، مما يعني أنها تتيح للباحثين تغيير تسلسل الحمض النووي بسهولة وتعديل وظيفة الجين.
؛؛وتقنية الكريسبر (CRISPR) لها العديد من التطبيقات المحتملة، بما في ذلك تصحيح العيوب الوراثية، وعلاج الأمراض ومنع انتشارها، وتحسين نمو المحاصيل ومرونتها. ومع ذلك، على الرغم من وعود التكنولوجيا، فإنها تثير بعض المخاوف الأخلاقية؛؛
وكريسبر عبارة عن امتدادات متخصصة من الحمض النووي، والبروتين (Cas9) – حيث يرمز كاس إلى “مرتبط بـ CRISPR” – هو إنزيم يعمل مثل زوج من المقص الجزيئي، القادر على قطع خيوط الحمض النووي.
تم تكييف تقنية كريسبر من آليات الدفاع الطبيعي للبكتيريا والعتائق، وهو مجال من الكائنات الحية الدقيقة أحادية الخلية البسيطة نسبيًا وتستخدم هذه الكائنات (RNA) المشتق من (CRISPR) ، وهو ابن عم جزيئي للحمض النووي، والعديد من بروتينات (Cas) لإحباط هجمات الفيروسات.
لإحباط الهجمات، تقوم الكائنات الحية بتقطيع الحمض النووي للفيروسات ثم تخزين أجزاء من هذا الحمض النووي في الجينوم الخاص بها، لاستخدامها كسلاح ضد الغزاة الأجانب في حالة هجوم تلك الفيروسات مرة أخرى.
عندما يتم نقل مكونات كريسبر إلى كائنات أخرى أكثر تعقيدًا، يمكن لهذه المكونات بعد ذلك معالجة الجينات، وهي عملية تسمى “تحرير الجينات”.
ومن هؤلاء العلماء الذين اجروا أبحاث باستخدام هذه التقنية، العالم الصيني وانج وزملائه من الأكاديمية الصينية للعلوم في بكين ونشرت هذه الابحاث في مجلة (Science Translational Medicine) حيث أجرى وانج وآخرون العديد من التجارب على نطاق الجينوم على أساس (CRISPR-Cas9) لتحديد الجينات التي يمكن أن تؤثر على الشيخوخة الخلوية.
حددوا (KAT7) كمحرك للشيخوخة في الخلايا الجذعية البشرية البالغة وأدى إبطال مفعول (KAT7) إلى تجديد الخلايا البشرية البروجرويدية التي تقدمت في السن قبل الأوان، كما أدى إلى إطالة عمر الفئران.
بينما من المعروف أن الشيخوخة الخلوية (حالة توقف النمو الدائم) تؤدي إلى تقدم الشيخوخة، فإن كيفية حدوث هذه العملية لا تزال غير واضحة. إن فهمنا لما يحرك الشيخوخة الخلوية مفيد في تطوير التدخلات لتعزيز مكافحة الشيخوخة وطول العمر.
عندما نشر وانغ وزملاؤه من الأكاديمية الصينية للعلوم في بكين مقالاهم في مجلة (Science Translational Medicine) قاموا فيه بالتنقيب عن الجينات التي يمكن أن تؤثر على الشيخوخة الخلوية.
لقد قاموا بنزع الحمض النووي من الخلايا البشرية التي تقوم بنمذجة الشيخوخة باستخدام أداة تحرير الجينات كريسبر للجينات التي يؤدي نقصها إلى تخفيف شيخوخة الخلايا و أنتجت هذه الشاشة (KAT7) ، والتي ، عند تعطيلها ، أدت إلى تجديد شباب الخلايا البشرية التي تقدمت في العمر قبل الأوان. عندما عطلوا (KAT7) في الفئران التي تقدمت في العمر بشكل طبيعي ومبكر، تم إطالة عمر القوارضين.
و حيث تركز هذه الدراسة على (KAT7) كهدف علاجي لتطوير التدخلات المضادة للشيخوخة حيث اثبتت وبالدليل على أنه يمكن استخدام تحرير الجينات المعتمد على كريسبر لتعزيز طول العمر.
قال المؤلفون في مقالهم: “تضيف دراستنا مثالًا آخر يوضح إمكانية استخدام العلاج الجيني لمقاومة الشيخوخة والاضطرابات المرتبطة بالشيخوخة”.
إبطاء الشيخوخة الخلوية عند البشر
الشيخوخة هي عملية لا مفر منها على ما يبدو تؤدي إلى تدهور وظيفي في جميع الكائنات الحية تقريبًا. وظهور الشيخوخة الخلوية مؤخرًا كعلامة مميزة للشيخوخة ومحرك أساسي لعمليات الشيخوخة حيث تتراكم الخلايا الشائخة في الأنسجة بمرور الوقت ، مما يؤدي إلى ظهور السمات الطبيعية لشيخوخة الجسم والمساهمة في الأمراض المرتبطة بالشيخوخة مثل التهاب المفاصل ومرض الزهايمر.
الخلايا الشائخة لا تدل فقط على الشيخوخة؛ بل تلعب هذه الخلايا غير المتكاثرة دورًا مسببًا في شيخوخة الكائن الحي. على سبيل المثال، تتراكم الخلايا الشائخة تدريجيًا في الكبد المتحلل، في حين أن إزالة الخلايا الشائخة من الكبد يخفف من تطور التنكس الدهني الكبدي (أو مرض الكبد الدهني). لذلك، فإن تأخير الشيخوخة الخلوية أو عكسها قد يوفر نهجًا علاجيًا جديدًا لعلاج الاضطرابات المرتبطة بالشيخوخة.
على الرغم من أننا أصبحنا أكثر إلمامًا بما يحدث لجسم الإنسان مع تقدمنا في العمر، إلا أن معظم ما نعرفه عن الجينات التي تلعب دورًا في الشيخوخة ينشأ من التجارب التي تستخدم كائنات نموذجية قصيرة العمر، مثل الخميرة والديدان والذباب، والسمك. لذلك، يظل توضيح البرامج الجينية التي تحكم شيخوخة الإنسان هدفًا مهمًا.
شاشة تحدد الجينات الجديدة المحفزة للشيخوخة البشرية
استخدم وانج وزملاؤه أداة الهندسة الوراثية القوية كريسبر لحذف أجزاء صغيرة من الحمض النووي لتحديد الجينات التي تؤثر على الشيخوخة باستخدام نوعين من الخلايا البشرية التي تظهر شيخوخة متسارعة. حملت هذه الخلايا الطفرات المسببة للأمراض التي تسبب أمراض الشيخوخة المبكرة متلازمة ويرنر (WS) ومتلازمة هتشينسون جيلفورد بروجيريا (HGPS). حدد فريق البحث الجينات التي خفف نقصها من الشيخوخة الخلوية، بما في ذلك (KAT7)، الذي احتل المرتبة الأولى في كل من نماذج الخلايا البشرية (WS) و (HGPS) المبكرة الشيخوخة.
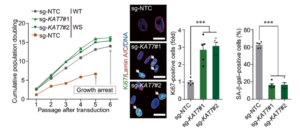
وللتحقق مما إذا كان نقص (KAT7) يخفف من الشيخوخة، استهدف وانج وزملاؤه (KAT7) لإسكات الجينات بواسطة (CRISPR) في (WS) و (HGPS) والخلايا الجذعية البالغة المتكاثرة. وجدوا أن استئصال (KAT7) في جميع النماذج الثلاثة أدى إلى تحسين إمكانات التكاثر وتخفيف ميزات الشيخوخة. علاوة على ذلك، فإن استئصال (KAT7) يخفف من أعراض الشيخوخة من السرطان والأشعة فوق البنفسجية والإجهاد التأكسدي. وتشير هذه النتائج إلى أن استنفاد (KAT7) يخفف من الشيخوخة في سياقات بيولوجية متنوعة.
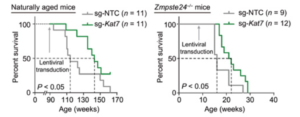
أخيرًا، أراد وانج وزملاؤه اختبار نهج العلاج الجيني كريسبر المضاد للشيخوخة في الحيوانات الحية. لذلك، اختبر الباحثون تأثير تعطيل (KAT7) باستخدام كريسبر في الفئران التي تقدمت في العمر بشكل طبيعي وقبل الأوان. باستخدام الفيروسات لإيصال مكونات كريسبر لتعطيل (KAT7) ، عند إعطائها عن طريق الوريد، رأى الباحثون أن هذا يخفف من شيخوخة خلايا الكبد وشيخوخة الكبد بالإضافة إلى إطالة العمر الافتراضي للفئران التي تقدمت في العمر بشكل طبيعي وقبل الأوان.
وعلى الرغم من أن هذه التأثيرات واعدة، إلا أنها لم تظهر في الأعضاء الأخرى لأن الباحثين وجدوا فقط أن التعديل الجيني لـ (KAT7) يحدث في الكبد على الأرجح بسبب طريقة العلاج الفيروسي. ستحتاج الدراسات المستقبلية إلى فحص نتائج استهداف (KAT7) في المزيد من أنواع الخلايا أو الأعضاء المحددة لتحديد الوظيفة ونطاق الأمان لتدخل (KAT7).
هل يمكن استخدام كريسبر كعلاج مضاد للشيخوخة؟
“تضيف دراستنا طبقة من التعقيد إلى وظيفة (KAT7) من خلال الكشف عن دورها المهم في بيولوجيا الشيخوخة وتحديد (KAT7) كهدف جديد لتأخير الشيخوخة وعلاج الاضطرابات المرتبطة بالشيخوخة” ، قال المؤلفون في المقال. “بالإضافة إلى الكشف عن دور (KAT7) في التوسط في الشيخوخة، حددت شاشتنا جينات الشيخوخة الإضافية التي قد تستهدف تحسين العمليات المرتبطة بالشيخوخة”.
علاوة على ذلك، تُظهر هذه الدراسة أن التحرير الجيني المستند إلى (CRISPR) يمكن أن يعطل جينات الشيخوخة مثل (KAT7) لتجديد الخلايا البشرية. وعلى الرغم من أن هذه الاستراتيجية العلاجية لمكافحة الشيخوخة واعدة، إلا أنه من السابق لأوانه معرفة ما إذا كانت هذه التقنيات القائمة على كريسبر ستكون فعالة في البشر لتحسين فترة الصحة وطول العمر.
المصادر:
- https://www.theguardian.com/science/2022/jun/01/research-may-reveal-why-people-can-suddenly-become-frail-in-their-70s
- https://www.bayshore.ca/2018/09/20/the-physical-changes-of-aging/
- https://nypost.com/2019/03/02/science-has-figured-out-how-to-freeze-the-aging-process/
- https://www.synthego.com/blog/can-crispr-stop-us-from-aging
- https://createdigital.org.au/crispr-turn-back-clock-ageing/
 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية
