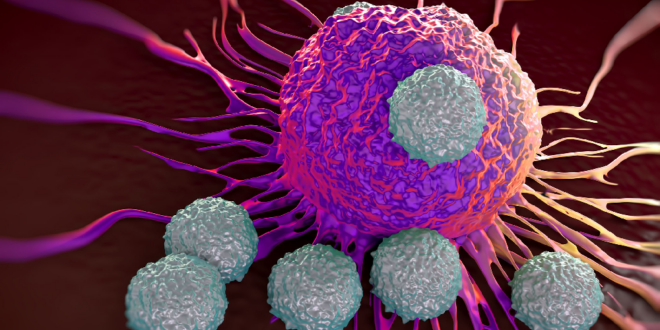
The race to supercharge cancer-fighting T cells
(Heidi Ledford – بقلم: هايدس ليدفورد)
ملخص المقالة:
أدى التقدم في تعديل الجينوم والقدرة على إعادة توصيل الخلايا إلى أساليب أكثر تطورًا لتعديل الخلايا التائية وشحنها الفائق للعلاج، حيث توفر هذه التقنيات أدوات لمواجهة بعض القيود المفروضة على علاجات “الخلايا التائية بمستقبلات المستضد الخيمري” الحالية الباهظة الثمن، ويمكن أن يكون لها آثار جانبية خطيرة، إذ أنها لم تنجح حتى الآن إلا في علاج سرطانات الدم. وقد وسعت هذه التقنيات ما يمكن القيام به باستخدام استراتيجيات مستقبلات المستضد الخيمري، التي سوف تأخذ هذا النوع من التقنية إلى الأمام حقًا. ولكن التحدي المتمثل في صنع مثل هذا “الدواء الحي” بواسطة خلايا الشخص يتجاوز التصاميم المعقدة. ولا تزال مشاكل السلامة والتصنيع بحاجة إلى معالجة للعديد من أحدث المرشحين لهذا العلاج.
( المقالة )
باستخدام عدد كبير من الأدوات لخداع الخلايا المناعية، يعمل الباحثون على توسيع مخزون علاجات “الخلايا التائية بمستقبلات المستضد الخيمري” (“chimeric antigen receptors – “CAR-T).
[اضافة من المترجم: خيمري يتعلق أو يشير إلى كائن حي يحتوي على مزيج من أنسجة مختلفة وراثيًا، تتشكل من عمليات مثل اندماج الأجنة المبكرة أو التطعيم أو الطفرة].

تتذكر البروفيسور كريستال ماكال[1] شكوكها في المرة الأولى التي سمعت فيها حديثًا عن طريقة لهندسة الخلايا التائية للتعرف على السرطان وقتله. وأثناء جلوسها بين الحضور في اجتماع عام 1996 في ألمانيا، التفت البروفيسور ماكال، وهي أخصائية أورام الأطفال، إلى الشخص المجاور لها وقالت: “مستحيل. هذا جنون جدا”.
اليوم، الأمور مختلفة. “لقد شعرت بالتواضع”، تقول البوفيسور ماكال، التي تعمل الآن في جامعة ستانفورد في كاليفورنيا، مطورة مثل هذه الخلايا لعلاج أورام الدماغ. وقد وافقت إدارة الغذاء والدواء الأمريكية على أول الخلايا التائية (T Cells) المعدلة، المسماة “الخلايا التائية بمستقبلات المستضد الخيمري”[2] ((CAR) -T Cells)، لعلاج شكل من أشكال سرطان الدم في عام 2017. وأصبحت العلاجات تغير قواعد اللعبة للعديد من أنواع السرطان. وتمت الموافقة على خمسة منتجات مماثلة، وحصل عليها أكثر من 20000 شخص. إن المجال الذي كان يديره في يوم من الأيام حفنة من الباحثين المصرين (العنيدين) يضم الآن مئات المجموعات المختبرية في الأوساط الأكاديمية والصناعية. وتجري الآن أكثر من 500 تجربة سريرية، وتستعد مناهج أخرى للقفز من مختبر إلى عيادة بينما يتسابق الباحثون لتحسين تصميمات الخلايا التائية وتوسيع قدراتهم. وتتوقع البروفيسور ماكال أن “هذا المجال سوف يذهب أبعد من السرطان في السنوات القادمة”.
وقد أدى التقدم في تعديل الجينوم من خلال عمليات مثل كريسبر (CRISPR)، والقدرة على إعادة توصيل الخلايا من خلال علم الأحياء الاصطناعي، إلى أساليب أكثر تطورًا لتعديل الخلايا التائية وشحنها الفائق للعلاج. وتوفر هذه التقنيات أدوات لمواجهة بعض القيود المفروضة على علاجات “الخلايا التائية بمستقبلات المستضد الخيمري” الحالية، والتي تعتبر باهظة الثمن، ويمكن أن يكون لها آثار جانبية خطيرة، ولم تنجح حتى الآن إلا في علاج سرطانات الدم. ويقول البروفيسور أفيري بوسي، باحث في علم المناعة السرطاني بجامعة بنسلفانيا في فيلادلفيا: “لقد وسعت هذه التقنيات ما يمكننا القيام به باستخدام استراتيجيات مستقبلات المستضد الخيمري. سوف يأخذ هذا النوع من التقنية إلى الأمام حقًا”.
ومع ذلك، فإن التحدي المتمثل في صنع مثل هذا “الدواء الحي” من خلايا الشخص يتجاوز التصاميم المعقدة. ولا تزال مشاكل السلامة والتصنيع بحاجة إلى معالجة للعديد من أحدث المرشحين. ويقول عالم المناعة البروفيسور ميشيل سادلين في مركز “ميموريال سلون كيترينج” للسرطان في مدينة نيويورك: “هناك انفجار للأشياء الفاخرة جدًا، وأعتقد أن هذا رائع”. ويتابع: “لكن التعقيد لا يمكن دائمًا إحضاره كما يوصف في بيئة سريرية”.
مسرع وجاهز للانطلاق
تستفيد علاجات “الخلايا التائية بمستقبلات المستضد الخيمري” من أنشطة الخلايا التائية، وهي صيادات الجهاز المناعي الطبيعيات اللاتي يجبن الجسم بحثًا عن أشياء لا تنتمي له. والخلايا الأجنبية، أو تلك المصابة بفيروس، تعبر عن بروتينات غير عادية تعمل كمنارة للخلايا التائية، والتي يطلق بعضها حساءًا سامًا من الجزيئات لتدمير الخلايا غير الطبيعية. ويمكن أن تستهدف وظيفة البحث والتدمير هذه أيضًا الخلايا السرطانية للتخلص منها، ولكن غالبًا ما يكون للأورام طرق لنزع سلاح جهاز المناعة، مثل إخفاء البروتينات غير الطبيعية أو قمع وظيفة الخلايا التائية.
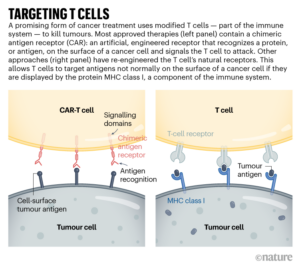
وتحمل “الخلايا التائية بمستقبلات المستضد الخيمري” البروتينات الاصطناعية – مستقبلات المستضدات الخيميرية – التي تمتد عبر غشاء الخلية. ويوجد في الخارج هيكل يعمل مثل الجسم المضاد، ويرتبط بجزيئات معينة على سطح بعض الخلايا السرطانية. وبمجرد أن يتم ربط ذلك، فإن جزء البروتين الموجود داخل الخلية يحفز نشاط الخلايا التائية، مما يؤدي إلى تفعيلها. والنتيجة هي آلة صغيرة سريعة الحركة لمكافحة السرطان.
وتستهدف علاجات “الخلايا التائية بمستقبلات المستضد الخيمري” المعتمدة واحدًا من نوعين من البروتينات الموجودة في الخلايا المناعية تسمى الخلايا البائية[3] (B cells)، وتستخدم لعلاج أشكال معينة من سرطان الدم والأورام اللمفاوية التي تنطوي على تكاثر غير مقيد لهذه الخلايا. والبروتينات – سي دي 19[4] (CD19) ومستضد نضج الخلايا البائية[5] (B-cell maturation antigen (BCMA)) – ليست فريدة من نوعها بالنسبة للسرطان، مما يعني أن العلاجات تقتل الخلايا البائية بشكل عشوائي. ومع ذلك، يمكن للناس العيش بدون هذه الخلايا.
ولا يزال هناك مجال كبير لتحسين علاجات “الخلايا التائية بمستقبلات المستضد الخيمري”. وعلى الرغم من أن الآثار يمكن أن تكون طويلة الأمد – وحتى علاجية في بعض الأحيان – إلا أن السرطان يعود في النهاية لدى معظم الأشخاص الذين تم علاجهم. والأورام الصلبة، مثل تلك الموجودة في سرطان الرئة أو البنكرياس، لم تستجب حتى الآن بشكل مقنع لـ “الخلايا التائية بمستقبلات المستضد الخيمري”. وينطوي العلاج على مخاطر تتعلق بالسلامة ويمكن، في حالات نادرة، أن يكون قاتلاً. ويجب أن تكون مصنوعة خصيصًا لكل مستلم (مريض)، باستخدام الخلايا التائية الخاصة بهم كنقطة انطلاق، مما يؤدي إلى عملية تصنيع بطيئة نسبيًا ومكلفة.
ولا توجد، حتى الآن، حلول بسيطة لأي من هذه المشاكل. وتقول البروفيسور ماكال: “من الواضح أن أمامنا طريق طويل لنقطعه. لكننا نرى الآن إشارات واعدة”.
ويتم إحراز بعض التقدم ضد الأورام الصلبة، والتي غالبًا ما تحتوي على فسيفساء غير متجانسة من الخلايا التي لها مجموعات مختلفة من الطفرات. وهذا يعني أن العلاج بـ “الخلايا التائية بمستقبلات المستضد الخيمري” الموجه إلى بروتين متحور معين قد يعمل مع مجموعة فرعية واحدة فقط من الخلايا. وقد يكون من الصعب أيضًا على الخلايا التائية اختراق الكتلة الضيقة للورم الصلب، وقد كافح الباحثون للعثور على أهداف مناسبة لا تعيث فسادًا في الأنسجة السليمة.
وعلى الرغم من ذلك، أظهرت بعض التجارب السريرية بصيصا من الفعالية. وقد صممت البروفيسور ماكال وزملاؤها “الخلايا التائية بمستقبلات المستضد الخيمري” لاستهداف جزيء يسمى “جي دي 2”[6] (GD2)، والذي يتم التعبير عنه بمستويات عالية بواسطة بعض سرطانات الدماغ والحبل الشوكي تسمى الأورام الدبقية[7]. وأعطى الفريق جرعة واحدة في الوريد من علاج “الخلايا التائية بمستقبلات المستضد الخيمري” للأشخاص المصابين بالأورام الدبقية، ثم قاموا بإعطاء جرعات متعددة منخفضة مباشرة في الدماغ. وذكرت هي وزملاؤها العام الماضي أن ثلاثة من أربعة أشخاص عولجوا بهذه الطريقة استجابوا بشكل إيجابي(1). وتقول البروفيسور ماكال: “تغوص هذه الخلايا في الدماغ. والجسد لا يرفضها هناك – إنه يلعب في تلك المساحة ذات الامتيازات المناعية”.
وقد يتطلب استهداف الأورام الصلبة علاجات الخلايا التائية التي تتعرف على أكثر من بروتين متحور أو يمكنها استهداف الخلايا السرطانية التي تعبر عن مستويات أعلى من بروتين معين مقارنة بالخلايا الطبيعية. وقد أخذت إحدى التجارب السريرية، التي أبلغت عن النتائج في نوفمبر 2022، هذا إلى أقصى الحدود: بدلاً من استخدام مستقبلات المستضد الخيميري، استخدم الفريق تقنية “كريسبر” لهندسة مستقبلات الخلايا التائية الطبيعية (انظر “استهداف الخلايا التائية”) للتعرف على البروتينات المتحورة (التي حدثت بها طفرة) الموجودة في ورم كل مشارك(2). وتلقى الأفراد مزيجًا من الخلايا التي تستهدف بروتينات مختلفة، على أمل أن تكون الأورام الصلبة أقل عرضة لتطوير مقاومة للعلاج ذي الأهداف المتعددة. وقد توقفت الأورام عن النمو في 5 من 16 مشاركًا بعد 28 يومًا من العلاج. ويأمل الباحثون في تعديل البروتوكول (العلاجي)، بما في ذلك إعطاء جرعات أعلى، لتعزيز الفعالية.
ويقول عالم المناعة البروفيسور كارل جون في جامعة بنسلفانيا إن القدرة على تتبع نشاط الخلايا التائية وضبطه تتحسن أيضًا. ومن خلال تحليلات أحادية الخلية المتقدمة، يمكن للباحثين متابعة مصير كل من الخلايا المهندسة والأورام المصممة لقتلها. ويمكنهم تحديد الخلايا التائية التي “استنفدت” – حالة خلل وظيفي يمكن أن تأتي من التحفيز لفترات طويلة – وأي الخلايا السرطانية أصبحت مقاومة للعلاج. ويمكنهم أيضًا معرفة ما إذا كانت البيئة المحيطة بالورم المُعالَج بـ “الخلايا التائية بمستقبلات المستضد الخيمري” قد أصبحت مليئة بالخلايا المثبطة للمناعة (مثل البلاعم أو الخلايا التائية التنظيمية). إن التغلب على هذا التثبيط المناعي المحلي سيكون مفتاحًا لتسخير الخلايا التائية لمحاربة الأورام الصلبة، كما يقول البروفيسور يانج بينج تشاو، كبير المسؤولين العلميين في “يو تي سي ثيروبيوتيكس” (UTC Therapeutics)، وهي شركة للتكنولوجيا الحيوية مقرها في سنغافورة تعمل على تطوير علاجات “الخلايا التائية بمستقبلات المستضد الخيمري”. ويضيف: “بغض النظر عن عدد الأهداف التي تستهدفها، إذا كان الورم يتهرب من الاستجابة المناعية، فلن يعمل”.
استخدم البروفيسور جون وزملاؤه نهج الخلية الواحدة لدراسة مقاومة علاجات “الخلايا التائية بمستقبلات المستضد الخيمري” التي تستهدف “سي دي 19″، ووجدوا أن منتجات “الخلايا التائية بمستقبلات المستضد الخيمري” التي كانت أقل قدرة على تنشيط بعض الخلايا التائية المساعدة ارتبطت بظهور المقاومة(3). كما استخدموا تقنيات الخلية الواحدة لمعرفة المزيد حول سبب فشل “الخلايا التائية بمستقبلات المستضد الخيمري” الموجهة ضد بروتين يسمى “ميسوثلين” (mesothelin)، الموجود في خلايا سرطان البنكرياس. وقد يؤدي تقليل نشاط اثنين من الجينات في الخلايا التائية ذات مستقبلات المستضدات الوهمية إلى تعزيز العلاج(4). ويقول البروفيسور جون: “سنكون قادرين على فهم آليات المقاومة هذه. وبعد ذلك مع كل هذه الأدوات مثل كريسبر، سنقوم بتصميم هندسي حولها”.
وبالإضافة إلى تعديل الخلايا التائية، تم استخدام تقنية كريسبر لإيجاد المزيد من الطرق لتغييرها. واستخدم البروفيسور ألكسندر مارسون، عالم المناعة في معاهد جلادستون في سان فرانسيسكو بولاية كاليفورنيا وزملاؤه تقنية كريسبر لتنشيط أو قمع آلاف الجينات في الخلايا التائية، ثم نظروا في تأثير التغييرات على إنتاج بروتينات أساسية تنظم المناعة تسمى السيتوكينات(5). وفي شاشة أخرى باستخدام تقنية كريسبر، وجد الفريق أن تقليل نشاط بروتين يسمى “راسا2” (RASA2) عزز قدرة “الخلايا التائية بمستقبلات المستضد الخيمري” على قتل أهدافها(6). ويقول البروفيسور مارسون: “نحن نتعلم دروسًا حول الجينات التي يمكننا تحويلها ورفضها لضبط الخلايا التائية لتتصرف كما نريد”.
وقد وضع علماء علم الأحياء الاصطناعي (البيولوجيا التخليقية) أيضًا أنظارهم على الخلايا التائية، وهم يقومون بتصميم دوائر خلوية متطورة يمكن أن تسمح بقدر أكبر من التحكم في التعبير عن مستقبلات المستضد الخيمري والبروتينات الأخرى التي قد تزيد من نشاط الخلايا التائية. وفي ديسمبر من العام الماضي، أفاد عالم الأحياء الاصطناعية البروفيسور ويندل ليم في جامعة كاليفورنيا بسان فرانسيسكو وزملاؤه(7) أنهم قاموا بهندسة الخلايا التائية للتعبير عن كل من مستقبلات المستضد الخيمري و انترلوكين 2[8] (Interleukin-2 (IL-2))، وهو بروتين منظم للمناعة.
ويمكن لـ انترلوكين 2 تحسين تغلغل الخلايا التائية في الأورام الصلبة والتغلب على الإشارات المثبطة للمناعة التي تطلقها الأورام، ولكن يمكن أن تكون سامة عندما تدار بشكل منهجي. إن السماح للخلايا التائية بإنتاج انترلوكين 2 يمكن من الإدارة المحلية (التحكم المحلي) للبروتين، والذي يمكن أن يتجاوز سميته للأنسجة الأخرى.
وتم تصميم الدوائر الاصطناعية الأخرى للسماح بالتنظيم الدقيق للتعبير عن مستقبلات المستضد الخيميري، من خلال وضعها تحت سيطرة العناصر الجينية التي تنشط الجينات الضرورية استجابةً لدواء(8). وحتى الآن، ومع ذلك، فإن معظم هذه التصميمات المعقدة لم تخضع بعد لدراسات السلامة والمقاييس المطلوبين للاستخدام في الأشخاص، كما يقول البروفيسور سادلين.
ويتعلم الباحثون دروسًا كثيرة لدرجة أن أحد الأسئلة المهمة في المجال الآن هو تحديد الخلايا التائية المهندسة للمضي قدمًا في الدراسات البشرية، كما تقول عالمة الأورام البروفيسور مارسيلا ماوس في مستشفى ماساتشوستس العام في بوسطن. وتشرح: “يمكننا أن نخترع ونبتكر كثيرًا في المختبر، ولكن هناك مسار لترجمة ذلك إلى تجارب إكلينيكية. هناك أشياء كثيرة يمكننا القيام بها. علينا معرفة أفضل الأشياء التي يمكن تعديلها واختبارها في التجارب”.
عمل مكلف
يعتبر تصنيع “الخلايا التائية بمستقبلات المستضد الخيمري” معقدًا إلى حد كبير وفقًا للمعايير الصيدلانية. وحتى الآن، تتطلب جميع العلاجات المعتمدة هندسة الخلايا التائية الخاصة بالفرد للتعبير عن مستقبلات المستضد الخيمري. وهذا يضيف إلى الوقت وبالتالي تكلفة إنتاج العلاجات: في الولايات المتحدة، يمكن أن يصل العلاج الفردي باستخدام خلايا “الخلايا التائية بمستقبلات المستضد الخيمري” إلى حوالي 500000 دولار أمريكي، بدون تضمين تكلفة العلاج في المستشفى والعلاجات المرتبطة به.
ويُنظر إلى إنشاء “الخلايا التائية بمستقبلات المستضد الخيمري” التي يمكن إعطاؤها لعدة أشخاص – غالبًا ما تسمى الخلايا الجاهزة – على أنها ضرورية لخفض سعر العلاج. ولكن النتائج الأولية تشير إلى أنه لا يزال هناك عمل يتعين القيام به، كما يقول المهندس الحيوي راهول بوروار في المعهد الهندي للتكنولوجيا في بومباي. وعلى الرغم من أنه يمكن تعديل الخلايا لتقليل فرصة القضاء عليها من قبل الجهاز المناعي، إلا أن التجارب المبكرة تشير إلى أنها لا تعيش لفترة طويلة بعد التسريب وربما يتم رفضها (انظر، على سبيل المثال ، المرجع 9)(9). ويضيف: “الجاهز هو أسلوب رائع. إنه قادم، لكننا الآن لم نصل إلى هناك بعد”.
ونادرًا ما يكون العلاج متاحًا خارج الدول الغنية. ففي البرازيل، كان اختصاصي أمراض الدم “ريناتو لويز جويرينو كونها” في مجموعة “اونكوكلينيكاس” (Oncoclínicas Group) في مدينة ساو باولو هو الأول في البلاد الذي يعالج شخصًا ما بعلاج “الخلايا التائية بمستقبلات المستضد الخيمري” في عام 2019. ولكن التقدم كان بطيئًا، كما يقول: إنه يفتقر إلى القدرة على إنتاج كميات كبيرة بسرعة الخلايا. ويتابع: “في غضون ثلاث سنوات، عالجنا ستة مرضى فقط. نحن بحاجة إلى تقنية جديدة للنهج”.
وعادةً ما ينطوي إنتاج العلاج بـ “الخلايا التائية بمستقبلات المستضد الخيمري” على استخدام نوع من الفيروسات يسمى الفيروس البطيء كقوة موجهة لنقل الجين الاصطناعي (التخليقي) مستقبلات المستضد الخيميري. ولكن المزيد من البحث في العلاجات الجينية أدى إلى زيادة الطلب على الفيروسات البطيئة من الدرجة السريرية. وينتظر الباحثون الآن شهورًا ويدفعون دولارات أعلى لإكمال تجاربهم؛ ينتج “كونها” بنفسه ولكن لا يمكنه فعل ذلك إلا بكميات ضئيلة. ويمكن أن تساعد التحسينات على تعديل كريسبر للجينات في هذا الصدد.
وعلى الرغم من التحديات، تستمر علاجات “الخلايا التائية بمستقبلات المستضد الخيمري” في التوسع، حيث تستكشف بعض مئات التجارب السريرية في جميع أنحاء العالم تطبيقات جديدة تمامًا. وفي العام الماضي، أعلن الباحثون عن نتائج واعدة في تجربة صغيرة من علاجات “الخلايا التائية بمستقبلات المستضد الخيمري” لعلاج شكل من أشكال مرض الذئبة(10). وفي دراسة أجريت على الفئران، أعاد الباحثون برمجة الخلايا التائية دون الخطوة الأولى المعتادة المتمثلة في إزالتها من الجسم، وإنشاء خلايا “الخلايا التائية بمستقبلات المستضد الخيمري” مصممة لإزالة النسيج الندبي من القلب(11).
وفي ديسمبر 2022، كشف البروفيسور جون وزملاؤه عن طريقة لانسيابية إنتاج الخلايا. وفي الاجتماع السنوي للجمعية الأمريكية لأمراض الدم في مدينة نيو أورلينز بولاية لويزيانا، أعلن الفريق(12) أن تقليل أوقات التصنيع وهندسة خلايا “الخلايا التائية بمستقبلات المستضد الخيمري” للتعبير عن بروتين يسمى “انترلوكين-18” (IL-18) عزز فعاليتها وسمح للباحثين بتقليل جرعة الخلايا الممنوحة للأشخاص. ويقول البروفيسور ماوس عن التجربة السريرية: “كان لدى هؤلاء المرضى استجابات مذهلة، والتي تعطيك هذا التلميح المحير حقًا أنه إذا قمت بهندسة الخلية التائية بشكل أفضل، يمكنك جعلها أكثر قوة”.
*تمت الترجمة بتصرف
المصدر:
The race to supercharge cancer-fighting T cells (nature.com) ; مجلة “الطبيعة” (Nature) عدد 613 صفحة 626-628 (2023) [doi: https://doi.org/10.1038/d41586-023-00177-z]
المراجع:
- Majzner, R. G. et al. Nature 603, 934–941 (2022).
- Foy, S. P. et al. Nature https://doi.org/10.1038/s41586-022-05531-1 (2022).
- Bai, Z. et al. Sci. Adv. 8, eabj2820 (2022).
- Good, C. R. et al. Cell 184, 6081–6100 (2021).
- Schmidt, R. et al. Science 375, eabj4008 (2022).
- Carnevale, J. et al. Nature 609, 174–182 (2022).
- Allen, G. M. et al. Science 378, eaba1624 (2022).
- Li, H-S. et al. Science 378, 1227–1234 (2022).
- Benjamin, R. et al. Lancet Haematol. 9, E833–E843 (2022).
- Mackensen, A. et al. Nature Med. 28, 2124–2132 (2022).
- Rurik, J. G. et al. Science 375, 91–96 (2022).
- Svoboda, J. et al. Blood 140 (Suppl. 1), 4612–4614 (2022).
الهوامش:
[1] البروفيسور كريستال ماكال (مواليد 21 أغسطس 1960) طبيبة وأخصائية مناعة أمريكية. وهي حاليًا أستاذة طب الأطفال والطب بكلية “إرنست وأميليا جالو” بجامعة ستانفورد. وهي المدير المؤسس لمركز ستانفورد للعلاج بالخلايا السرطانية، ومدير مساعد لمعهد ستانفورد للسرطان، ورئيس برنامج العلاج المناعي للسرطان مدير معهد “باركر” للعلاج المناعي للسرطان في جامعة ستانفورد. ويكيبيديا وموقع جامعة ستانفورد الالكتروني.
[2] العلاج بالخلايا التائية بمستقبلات المستضد الخيمري هي طريقة للحصول على الخلايا المناعية المسماة الخلايا التائية (نوع من خلايا الدم البيضاء) لمحاربة السرطان عن طريق تغييرها في المختبر حتى تتمكن من العثور على الخلايا السرطانية وتدميرها. أحيانًا يتم الحديث عن العلاج بـ “الخلايا التائية بمستقبلات المستضد الخيمري ” كنوع من العلاج الجيني القائم على الخلايا، لأنه يتضمن تغيير الجينات داخل الخلايا التائية لمساعدتها على مهاجمة السرطان. يمكن أن يكون هذا النوع من العلاج مفيدًا جدًا في علاج بعض أنواع السرطان، حتى عندما لا تعمل العلاجات الأخرى. أما كيف يعمل العلاج فإن الجهاز المناعي يتعرف على المواد الغريبة في الجسم عن طريق إيجاد بروتينات تسمى المستضدات على سطح تلك الخلايا. تحتوي الخلايا المناعية التي تسمى الخلايا التائية على بروتينات خاصة بها تسمى المستقبلات التي ترتبط بمستضدات أجنبية وتساعد في تحفيز أجزاء أخرى من الجهاز المناعي لتدمير المادة الغريبة. العلاقة بين المستضدات والمستقبلات المناعية تشبه القفل والمفتاح. مثلما لا يمكن فتح القفل إلا بالمفتاح الصحيح ، فإن لكل مستضد أجنبي مستقبل مناعي فريد قادر على الارتباط به. تحتوي الخلايا السرطانية أيضًا على مستضدات ، ولكن إذا لم يكن لخلاياك المناعية المستقبلات الصحيحة ، فلن تتمكن من الارتباط بالمستضدات وتساعد في تدمير الخلايا السرطانية. المصدر: CAR T-cell Therapy and Its Side Effects (cancer.org)
[3] الخلايا البائية، المعروفة أيضًا باسم الخلايا البائية الليمفاوية، هي نوع من خلايا الدم البيضاء من النوع الفرعي للخلايا الليمفاوية. وهي تعمل في عنصر المناعة الخلطية في جهاز المناعة التكيفي. تنتج الخلايا البائية جزيئات الأجسام المضادة التي يمكن إفرازها أو إدخالها في غشاء البلازما حيث تعمل كجزء من مستقبلات الخلايا البائية. ويكيبيديا.
الخلايا البائية الليمفاوية: نوع من خلايا الدم البيضاء التي تصنع الأجسام المضادة. تعد الخلايا البائية الليمفاوية جزءًا من جهاز المناعة وتتطور من الخلايا الجذعية في نخاع العظام. تسمى أيضًا بالخلية البائية. المصدر: Definition of B lymphocyte – NCI Dictionary of Cancer Terms – NCI
يحدث التطور المبكر للخلايا البائية والالتزام بسلالة الخلايا البائية في كبد الجنين قبل الولادة، قبل الاستمرار في نخاع العظام طوال الحياة. تقع الخلايا البائية في مركز الجهاز المناعي الخلطي التكيفي، وهي مسؤولة عن التوسط في إنتاج الغلوبولين المناعي (immunoglobulin (Ig)) الخاص بالمستضد الموجه ضد مسببات الأمراض الغازية (المعروفة عادةً باسم الأجسام المضادة). المصدر: B Cells | British Society for Immunology
[4] سي دي 19 (CD19) هو جزيء سطح خلية يتم التعبير عنه فقط بواسطة الخلايا الليمفاوية البائية والخلايا المتغصنة المسامية في النظام المكون للدم. إنه أقدم مستضدات مقيدة بنسب (سلالة) الخلايا البائية يتم التعبير عنه، وهو موجود في معظم خلايا ما قبل الخلايا البائية ومعظم خلايا سرطان الدم الليمفاوي الحاد غير التائية وخلايا سرطان الدم الليمفاوي المزمن (تيدر و اسحاق، 1989 – Tedde and Isaacs 1989). المصدر: CD19 Protein Overview: Sequence, Structure, Function and Protein Interaction | Sino Biological
سي دي 19 هو بروتين سكري مقيد بالخلايا البائية ينظم إشارات الخلايا البائية وبقائها على قيد الحياة. يتم التعبير عنه في معظم الأورام الخبيثة للخلايا البائية. تم تصميم الخلايا التائية المضادة لمستضد سي دي 19 الخيمري لتعزيز وظيفة الخلية المؤثرة من خلال التصويب لتسليم خلايا تائية مُصممة هندسيًا خاصة بمستضد الورم. المصدر: B-Cell Differentiation | Research | BMS Science | HCP Site
[5] مستضد نضج الخلايا البائية (B-cell maturation antigen – BCMA) هو بروتين عبر الغشاء يلعب دورًا رئيسيًا في تكاثر الخلايا البائية ونضجها وتمايزها إلى خلايا بلازما. إنه مهم لبقاء خلايا البلازما، ويتم التعبير عنه عالميًا في خلايا المايلوما، وهو هدف محتمل في علاج المايلوما المتعددة (multiple myeloma (MM)). المصدر: B-Cell Maturation Antigen | Research | BMS Science | HCP Site
[6] جي دي 2 (GD2) هو عبارة عن ديسيالوغانغليوسايد (disialoganglioside) يتم التعبير عنه في أورام من أصل الجلد العصبي ، بما في ذلك الورم الأرومي العصبي البشري وسرطان الجلد ، مع تعبير مقيد للغاية على الأنسجة الطبيعية ، بشكل أساسي في المخيخ والأعصاب الطرفية في البشر. إن التعبير النسبي للورم الخاص بـ جي دي 2 يجعله هدفًا مناسبًا للعلاج المناعي بأجسام مضادة وحيدة النسيلة أو بمستقبلات الخلايا التائية الاصطناعية. الغانغليوسايد هو جزيء يتكون من غليكوسفينغوليبيد (سيراميد وأوليغوساكاريد) مع واحد أو أكثر من أحماض السياليك (مثل حمض “ان-اسيتيلنيورامينيك” N-acetylneuraminic ، NANA) المرتبط بسلسلة السكر. ويكيبيديا.
[7] الورم الدبقي هو نمو للخلايا يبدأ في الدماغ أو النخاع الشوكي. تبدو الخلايا في الورم الدبقي مشابهة لخلايا الدماغ السليمة التي تسمى الخلايا الدبقية. تحيط الخلايا الدبقية بالخلايا العصبية وتساعدها على العمل. عندما ينمو الورم الدبقي، فإنه يشكل كتلة من الخلايا تسمى الورم. يمكن أن ينمو الورم ليضغط على أنسجة المخ أو النخاع الشوكي ويسبب الأعراض. تعتمد الأعراض على الجزء المصاب من الدماغ أو النخاع الشوكي. المصدر: Glioma – Symptoms and causes – Mayo Clinic
[8] اتنرلوكين-2 (Interleukin-2 (IL-2)) هو انترلوكين (interleukin)، وهو نوع من جزيئات إشارات السيتوكين في جهاز المناعة. وهو أي فئة من البروتينات السكرية التي تنتجها الكريات البيض لتنظيم الاستجابات المناعية. ويكيبيديا.

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية